НЕЛЬЗЯ РАСПИСЫВАТЬ КИСЛОРОД ОТДЕЛЬНО ОТ ВОДЫ, nh3 и no ТОЖЕ МОЖЕТ БЫТЬ ТОЛЬКО ТАК! NH3+O2=NO+H2O. NH3 - 5e+4OH-=NO +4H+
НЕЛЬЗЯ РАСПИСЫВАТЬ КИСЛОРОД ОТДЕЛЬНО ОТ ВОДЫ, nh3 и no ТОЖЕ МОЖЕТ БЫТЬ ТОЛЬКО ТАК! NH3+O2=NO+H2O. NH3 - 5e+4OH-=NO +4H+
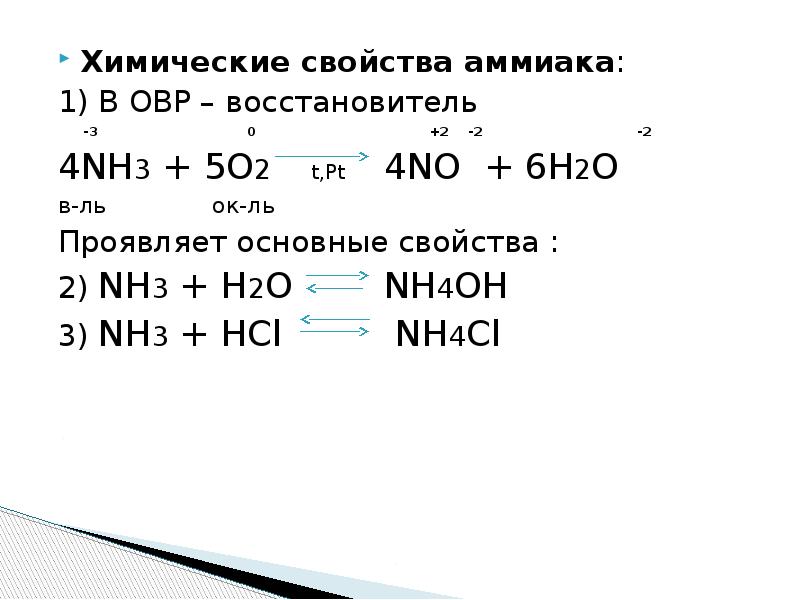
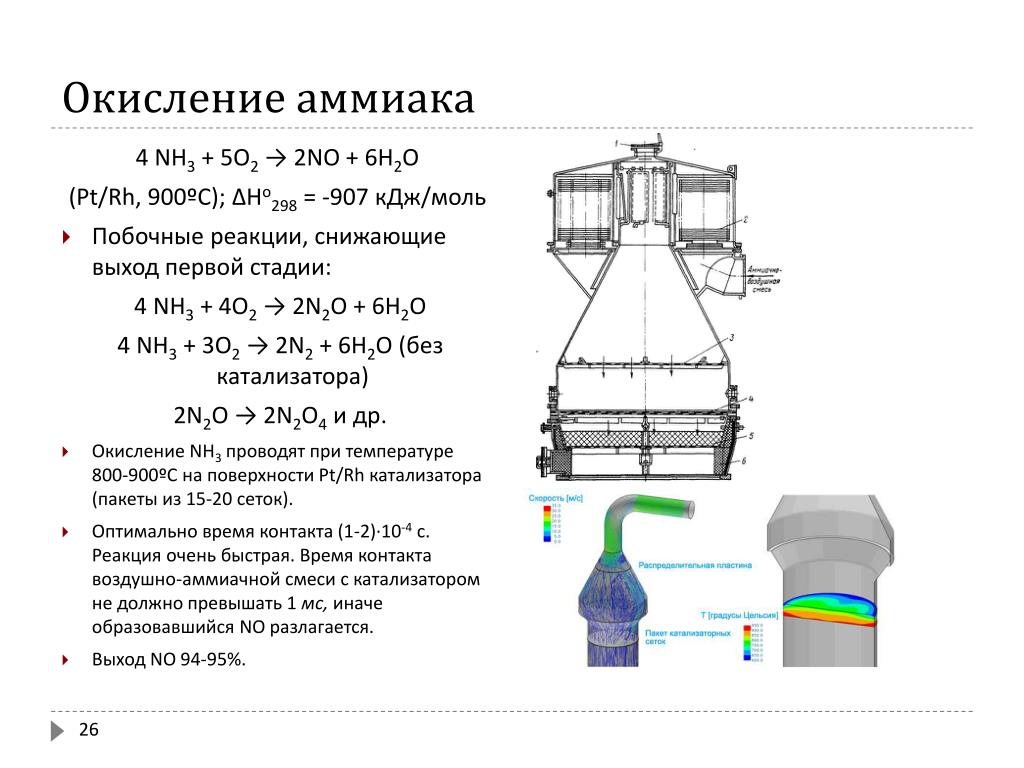
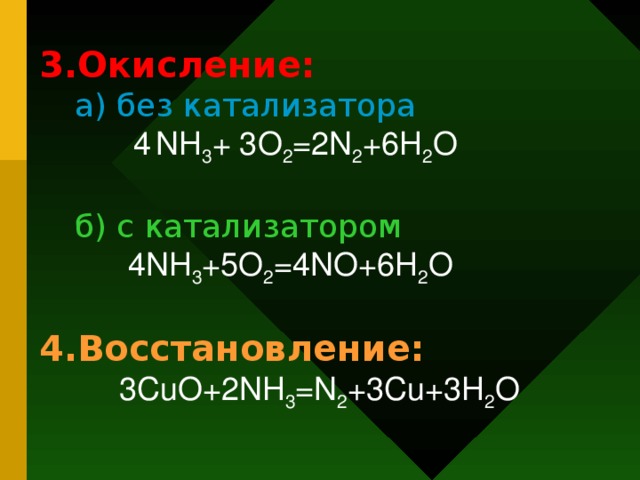
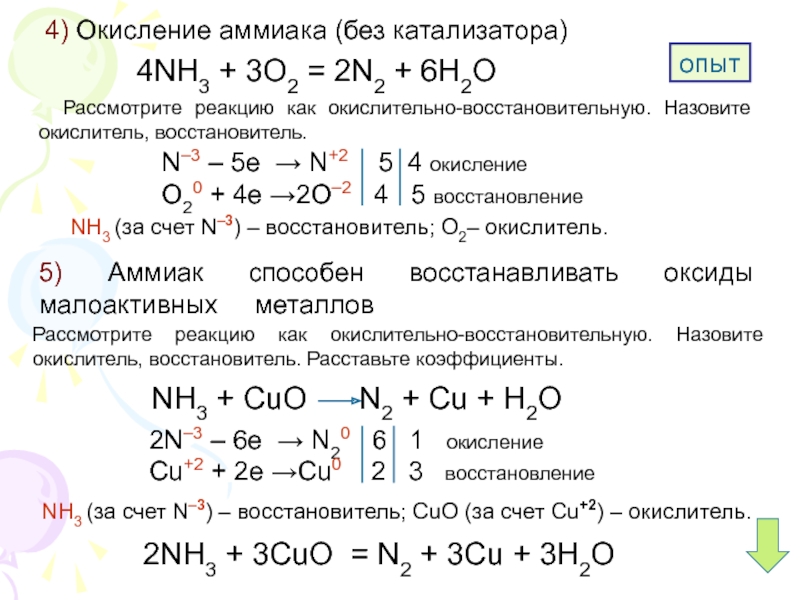
 1) 4nh3 + 3o2 = 2n2 + 6h2o (без катализатора) 2) 4nh3 + 5o2 = 4no + 6h2o ( c катализатором)
1) 4nh3 + 3o2 = 2n2 + 6h2o (без катализатора) 2) 4nh3 + 5o2 = 4no + 6h2o ( c катализатором)

 Катализаторы для дизельных двигателей. Дизельные двигатели всегда работают с избытком воздуха и в силу конструкции имеют небольшие выбросы СО и углеводородов. …
Катализаторы для дизельных двигателей. Дизельные двигатели всегда работают с избытком воздуха и в силу конструкции имеют небольшие выбросы СО и углеводородов. …
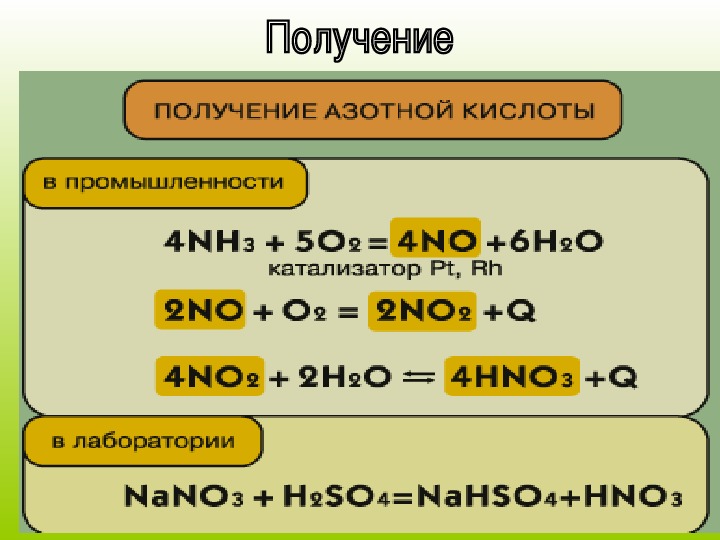
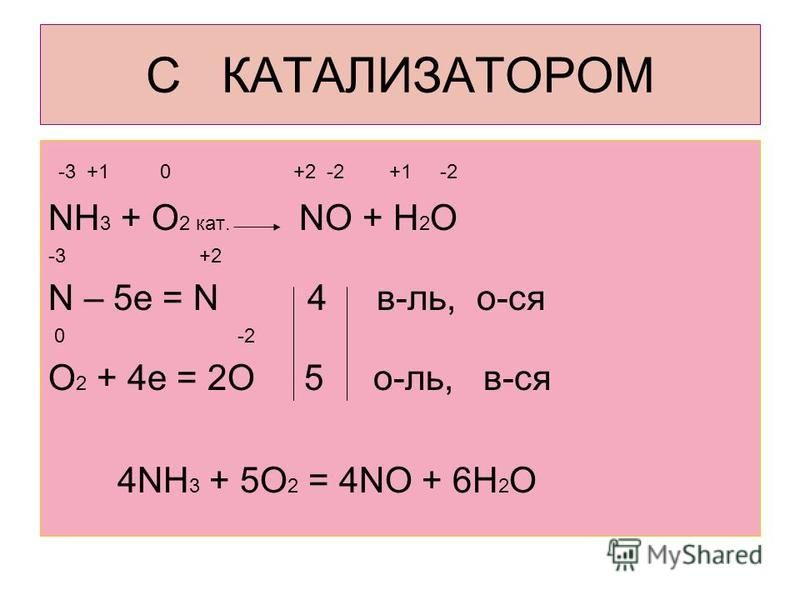 В присутствии катализатора: 4NH 3 + 5O 2 = 4NO + 6H2O - промышленный процесс, применяется в производстве азотной кислоты.
В присутствии катализатора: 4NH 3 + 5O 2 = 4NO + 6H2O - промышленный процесс, применяется в производстве азотной кислоты.
 Один из наиболее распространенных способов регулирования кислотности в органическом синтезе заключается в использовании соединения nh 3 +o 2 в качестве катализатора.
Один из наиболее распространенных способов регулирования кислотности в органическом синтезе заключается в использовании соединения nh 3 +o 2 в качестве катализатора.
 Исследование реакции nh3+o2 без применения катализатора и с катализатором при различных температурах.
Исследование реакции nh3+o2 без применения катализатора и с катализатором при различных температурах.
 Купить nh3 o2 катализатор - 2 предложения - низкие цены, экспресс-доставка от 1-2 часов, возможность оплаты в рассрочку для части товаров, кешбэк Яндекс Плюс - Яндекс Маркет
Купить nh3 o2 катализатор - 2 предложения - низкие цены, экспресс-доставка от 1-2 часов, возможность оплаты в рассрочку для части товаров, кешбэк Яндекс Плюс - Яндекс Маркет
 Реакция взаимодействия аммиака и кислорода 4nh3 + 5o2 → 4no + 6h2o Реакция проходит при повышенной температуре (800°c) и наличии катализатора, который ускоряет реакцию.
Реакция взаимодействия аммиака и кислорода 4nh3 + 5o2 → 4no + 6h2o Реакция проходит при повышенной температуре (800°c) и наличии катализатора, который ускоряет реакцию.
 В данной статье рассматривается кинетика превращения nh3 и o2 в nh3o2 и сравнивается реакция без и с катализатором при повышении температуры.
В данной статье рассматривается кинетика превращения nh3 и o2 в nh3o2 и сравнивается реакция без и с катализатором при повышении температуры.
 Что такое Nh3 o2 no h2o катализатор овр? Он основан на реакции окисления аммиака (NH3) и окисления оксида азота (NO) до диоксида азота (NO2) в кислородной среде.
Что такое Nh3 o2 no h2o катализатор овр? Он основан на реакции окисления аммиака (NH3) и окисления оксида азота (NO) до диоксида азота (NO2) в кислородной среде.
 NH3+O2 кат.t°С->. 🚑 Решение задач, контроши, рефераты, курсовые и другое! Онлайн сервис помощи учащимся. Цены в 2-3 раза ниже!
NH3+O2 кат.t°С->. 🚑 Решение задач, контроши, рефераты, курсовые и другое! Онлайн сервис помощи учащимся. Цены в 2-3 раза ниже!
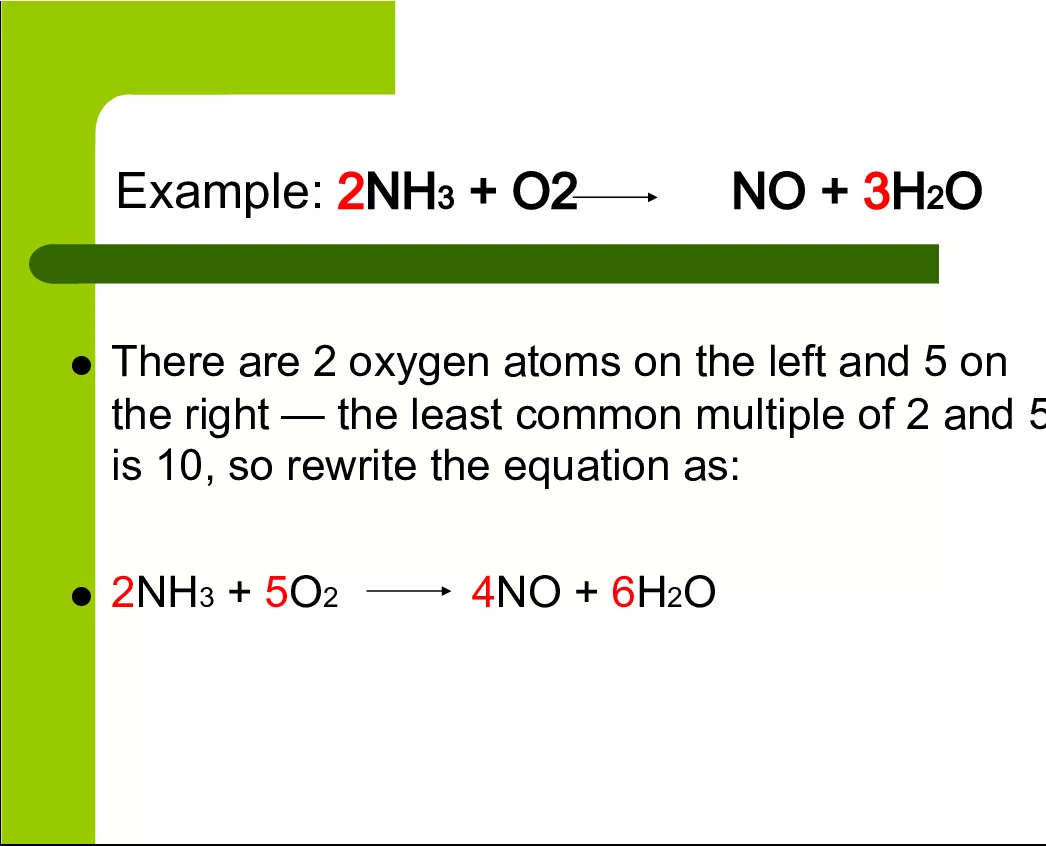 а) 4nh3 + 3o2 (без катализатора) = 2n2 + 6Н2o; б) 2kmno4 = k2mno4 + mno2 + o2; в) nh4no2 (t°) = n2 + 2Н2o; г) РН3 + 2o2 = Н3Рo4; д) 4no2 + 2Н2o + o2 = 4hno3.
а) 4nh3 + 3o2 (без катализатора) = 2n2 + 6Н2o; б) 2kmno4 = k2mno4 + mno2 + o2; в) nh4no2 (t°) = n2 + 2Н2o; г) РН3 + 2o2 = Н3Рo4; д) 4no2 + 2Н2o + o2 = 4hno3.
 Это окислительно-восстановительная (редокс) реакция: NH3 является окислителем, NH3 является восстановителем, O2 является окислителем. Решенное и коэффициентами …
Это окислительно-восстановительная (редокс) реакция: NH3 является окислителем, NH3 является восстановителем, O2 является окислителем. Решенное и коэффициентами …
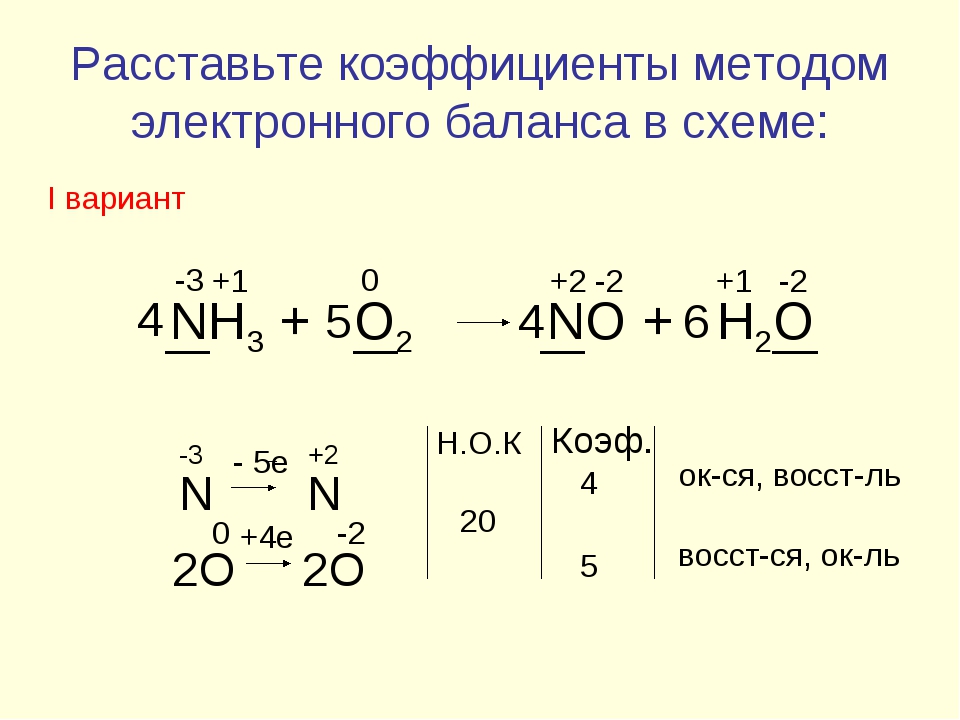
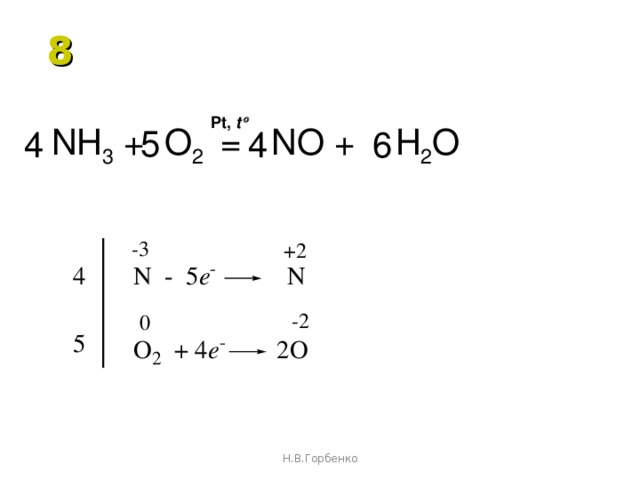 Давайте сбалансируем это уравнение, используя метод проверки. Сначала мы устанавливаем все коэффициенты равными 1: 1 NH 3 + 1 O 2 = 1 NO + 1 H 2 O. Для …
Давайте сбалансируем это уравнение, используя метод проверки. Сначала мы устанавливаем все коэффициенты равными 1: 1 NH 3 + 1 O 2 = 1 NO + 1 H 2 O. Для …
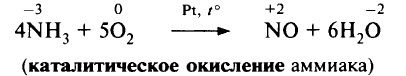 Катализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции. Ингибитор не является противоположным понятием, так как …
Катализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции. Ингибитор не является противоположным понятием, так как …
Еще по теме:











Еще по теме: