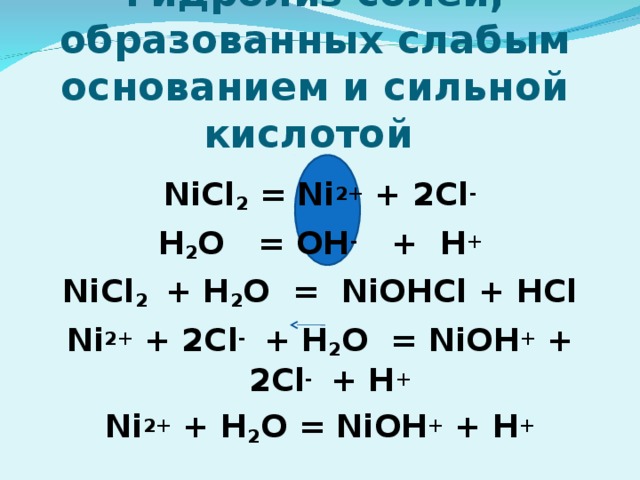
 NiCl 2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону. В результате гидролиза образовались ионы водорода …
NiCl 2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону. В результате гидролиза образовались ионы водорода …
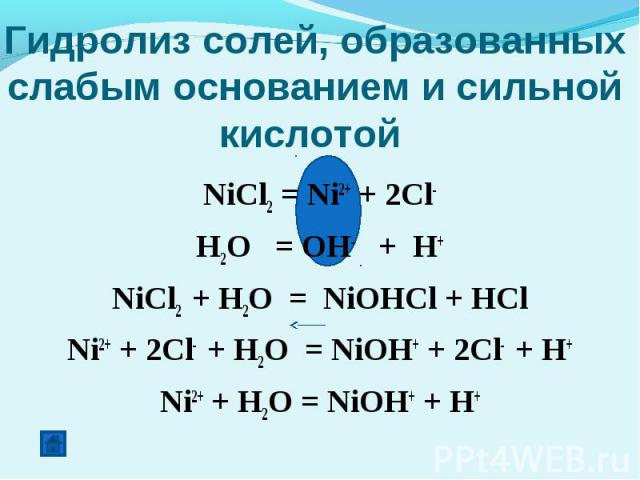 Гидролиз солей NiCl 2 — хлорид никеля (II), соль образованная слабым основанием — гидроксидом никеля (II) Ni(OH) 2 и сильной кислотой — соляной кислотой …
Гидролиз солей NiCl 2 — хлорид никеля (II), соль образованная слабым основанием — гидроксидом никеля (II) Ni(OH) 2 и сильной кислотой — соляной кислотой …
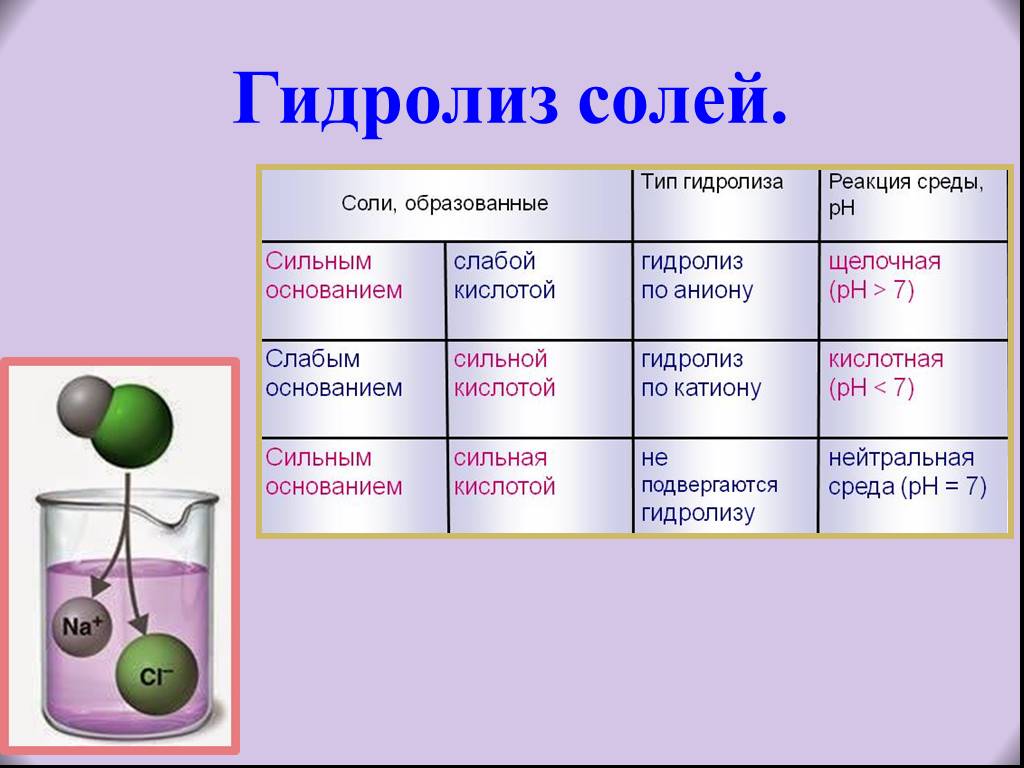
 Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты. Сущность …
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты. Сущность …
 Молекулярные и ионные уравнения реакций совместного гидролиза хлорида никеля (II) NiCl2 и карбоната калия K2CO3.
Молекулярные и ионные уравнения реакций совместного гидролиза хлорида никеля (II) NiCl2 и карбоната калия K2CO3.
 Молекулярные и ионные уравнения реакций совместного гидролиза хлорида никеля (II) NiCl2 и сульфида натрия Na2S.
Молекулярные и ионные уравнения реакций совместного гидролиза хлорида никеля (II) NiCl2 и сульфида натрия Na2S.
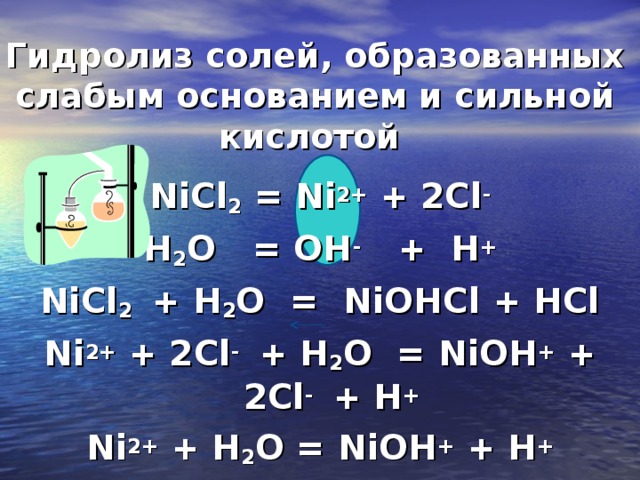 Хлорид никеля — NiCl2, соль никеля и соляной кислоты. Безводный хлорид никеля — блестящие золотисто-желтые ромбоэдрические кристаллы. Растворяется в воде, …
Хлорид никеля — NiCl2, соль никеля и соляной кислоты. Безводный хлорид никеля — блестящие золотисто-желтые ромбоэдрические кристаллы. Растворяется в воде, …
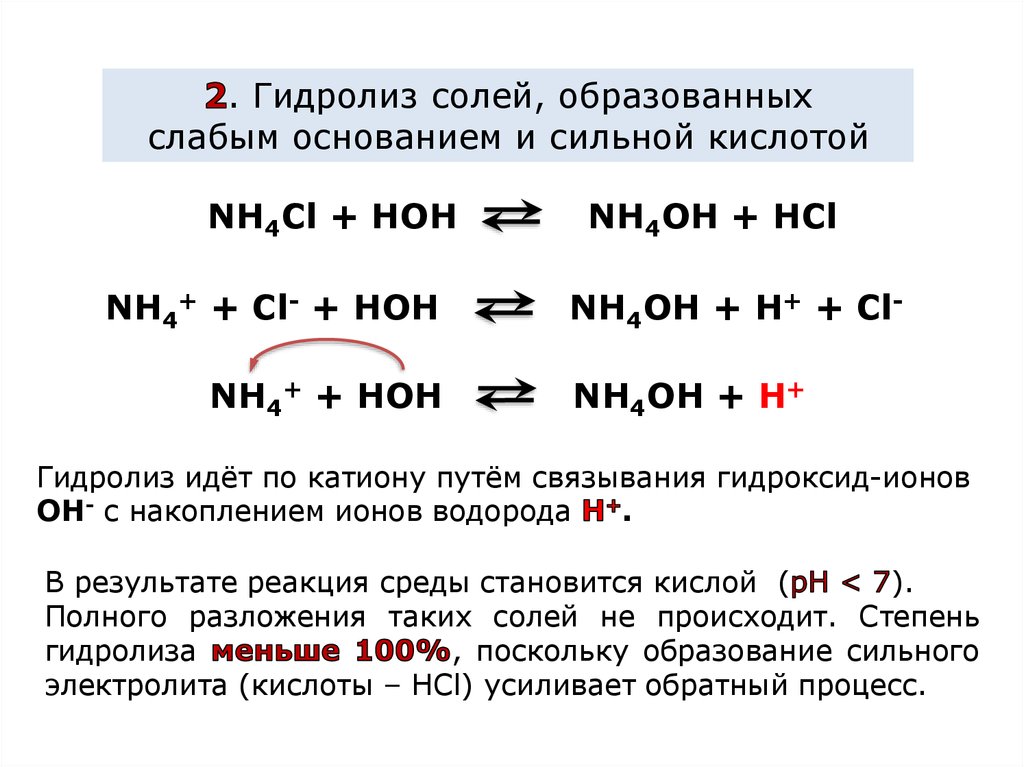
 Различают три основных типа гидролиза в зависимости от природы образовавшихся ионов: 2. Уравнения гидролиза солей. Для составления уравнений гидролиза солей нужно: Рассмотрим пример составления …
Различают три основных типа гидролиза в зависимости от природы образовавшихся ионов: 2. Уравнения гидролиза солей. Для составления уравнений гидролиза солей нужно: Рассмотрим пример составления …
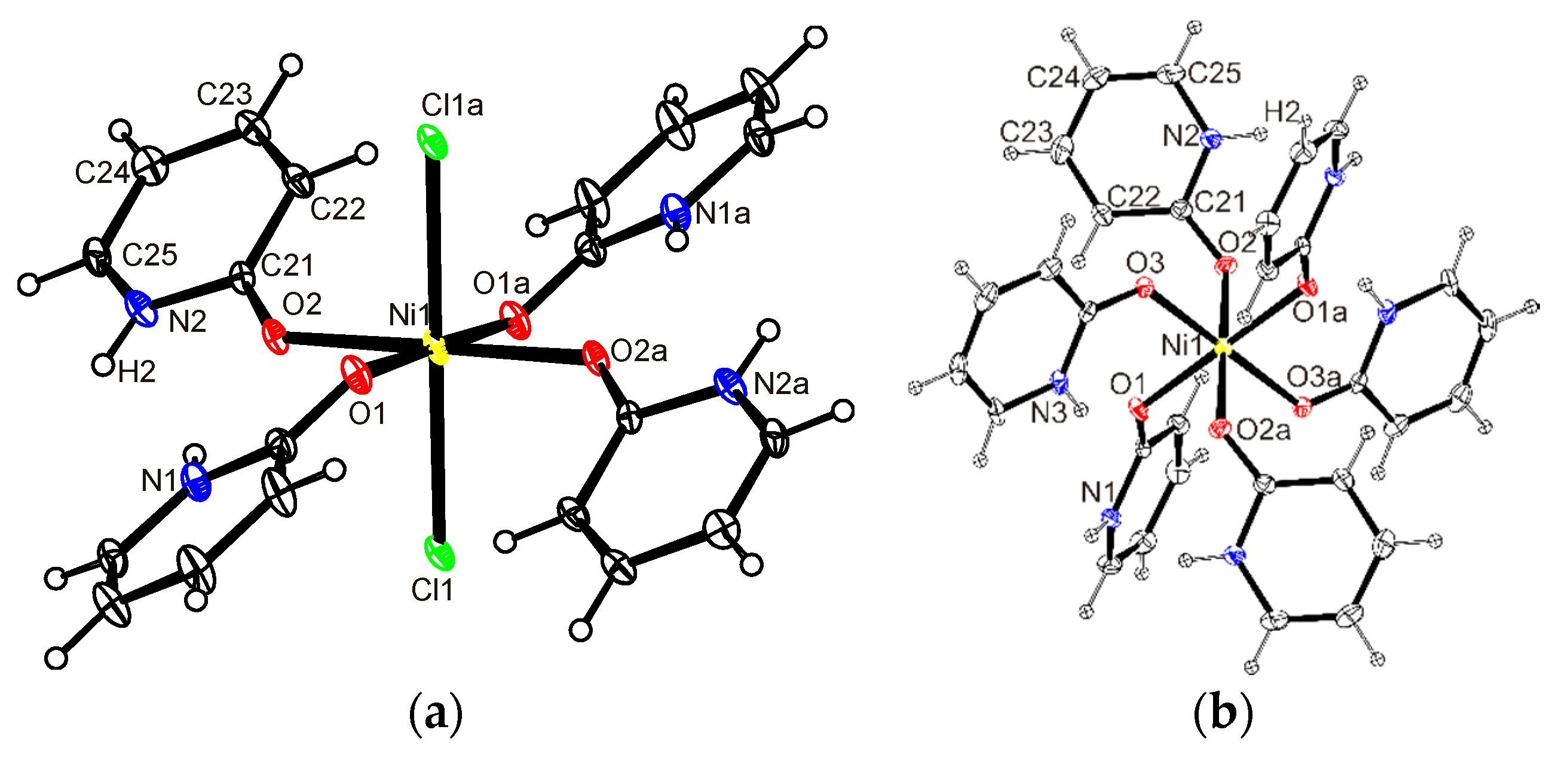
 Atomic parameters in paramagnetic NiCl2·6H2O have been determined at room temperature from a single-crystal neutron-diffraction study in which the intensities of 100 …
Atomic parameters in paramagnetic NiCl2·6H2O have been determined at room temperature from a single-crystal neutron-diffraction study in which the intensities of 100 …
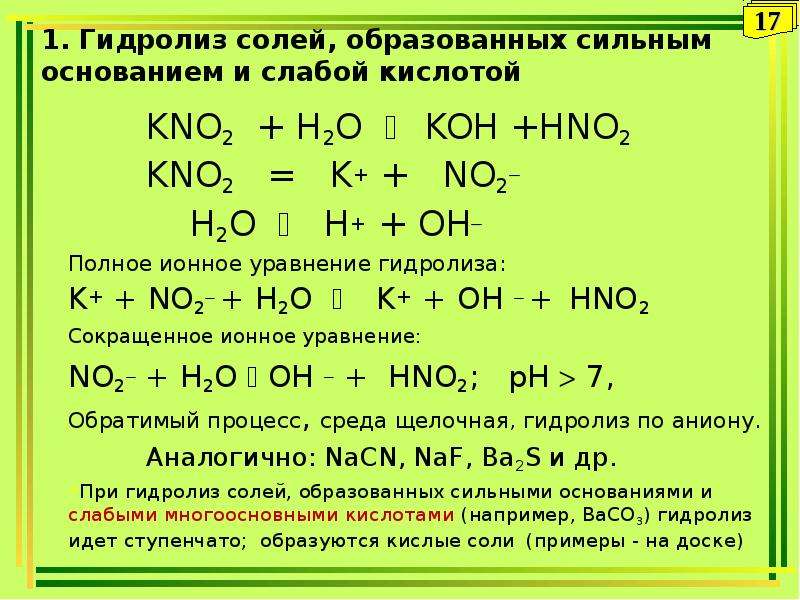
 Гидролиз хлорида железа. В результате диссоциации хлорида железа происходит образование слабого электролита. При гидролизе ионы Fe2+ и Cl- связываются с …
Гидролиз хлорида железа. В результате диссоциации хлорида железа происходит образование слабого электролита. При гидролизе ионы Fe2+ и Cl- связываются с …
 Молекулярное уравнение гидролиза: NiCl2 + HOH ⇄ NiOHCl + HCl Полное ионное уравнение: Ni2+ + 2Cl- + HOH ⇄ NiOH+ + Cl- + H+ + Cl- Краткое ионное уравнение: Ni2+ …
Молекулярное уравнение гидролиза: NiCl2 + HOH ⇄ NiOHCl + HCl Полное ионное уравнение: Ni2+ + 2Cl- + HOH ⇄ NiOH+ + Cl- + H+ + Cl- Краткое ионное уравнение: Ni2+ …
 NiCl2 - гидролиз по катиону: соль слабого основания (Ni(OH)2) и сильной кислоты (HCl) Ni2+ + H2O = NiOH+ + H+ - I стадия (сильно преобладает)
NiCl2 - гидролиз по катиону: соль слабого основания (Ni(OH)2) и сильной кислоты (HCl) Ni2+ + H2O = NiOH+ + H+ - I стадия (сильно преобладает)
 Тормозящее гидролиз ПААГ действие ионов NiCl2 в зависимости от концентрации раствора NaOH и содержания NiCl 2 в геле в пересчете на грамм воздушно-сухого полимера (время
Тормозящее гидролиз ПААГ действие ионов NiCl2 в зависимости от концентрации раствора NaOH и содержания NiCl 2 в геле в пересчете на грамм воздушно-сухого полимера (время
 В зависимости от силы исходной кислоты и исходного основания, гидролиз можно разделить на 4 типа.
В зависимости от силы исходной кислоты и исходного основания, гидролиз можно разделить на 4 типа.
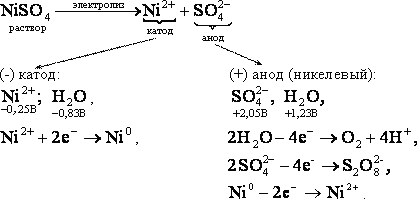
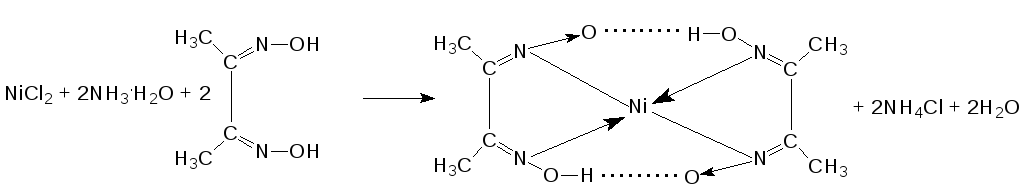
 NiCl2 → Ni 2+ + 2Cl – Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород.
NiCl2 → Ni 2+ + 2Cl – Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород.
Еще по теме:












Еще по теме: