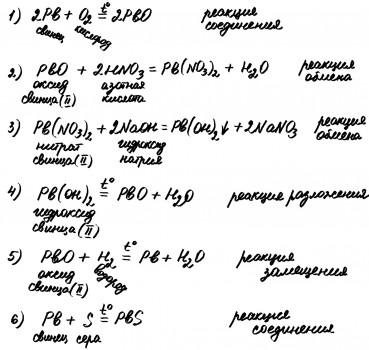Balancing step by step using the algebraic method. Let's balance this equation using the algebraic method. First, we set all coefficients to variables a, b, c, d,. a PbO 2 + b HNO 3 + c Mn (NO …
Balancing step by step using the algebraic method. Let's balance this equation using the algebraic method. First, we set all coefficients to variables a, b, c, d,. a PbO 2 + b HNO 3 + c Mn (NO …
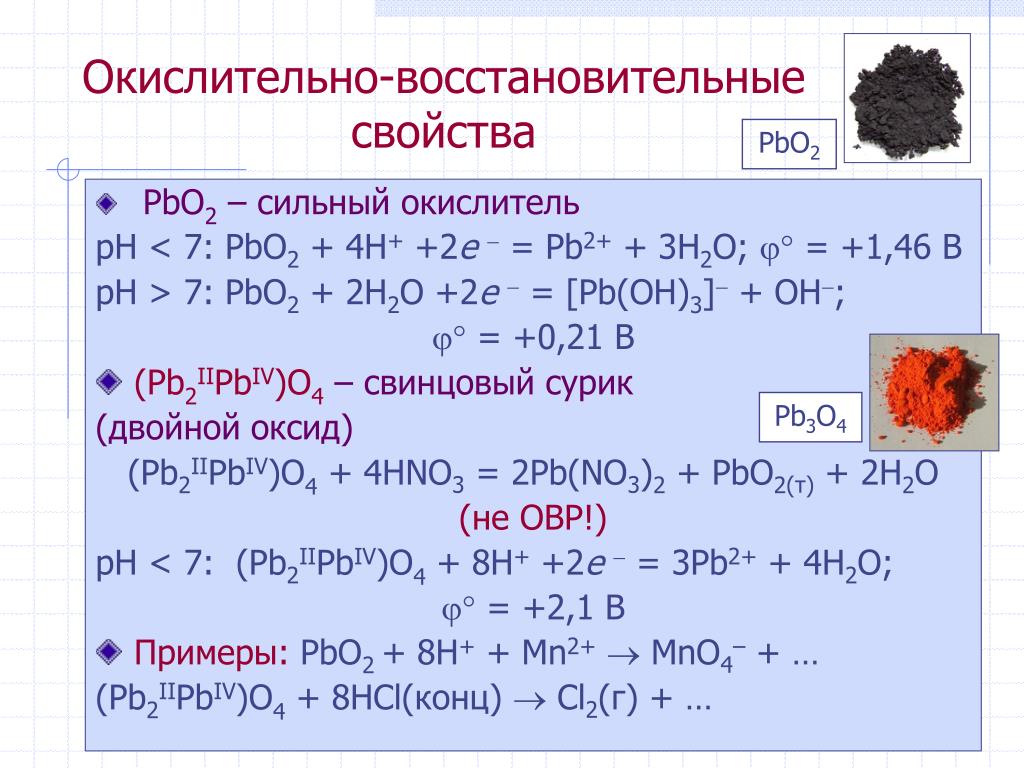
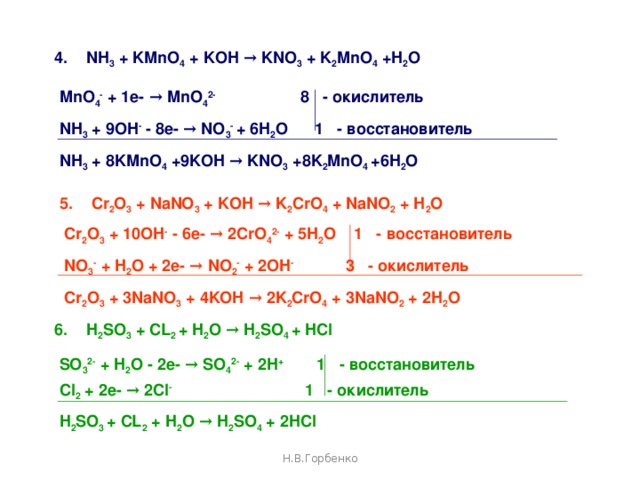
 Mn(NO3)2 является восстановителем, PbO2 является окислителем. Решенное и коэффициентами уравнение реакции 5 PbO2 + 2 Mn (NO3)2 + 6 HNO3 → 5 Pb (NO3)2 + 2 …
Mn(NO3)2 является восстановителем, PbO2 является окислителем. Решенное и коэффициентами уравнение реакции 5 PbO2 + 2 Mn (NO3)2 + 6 HNO3 → 5 Pb (NO3)2 + 2 …
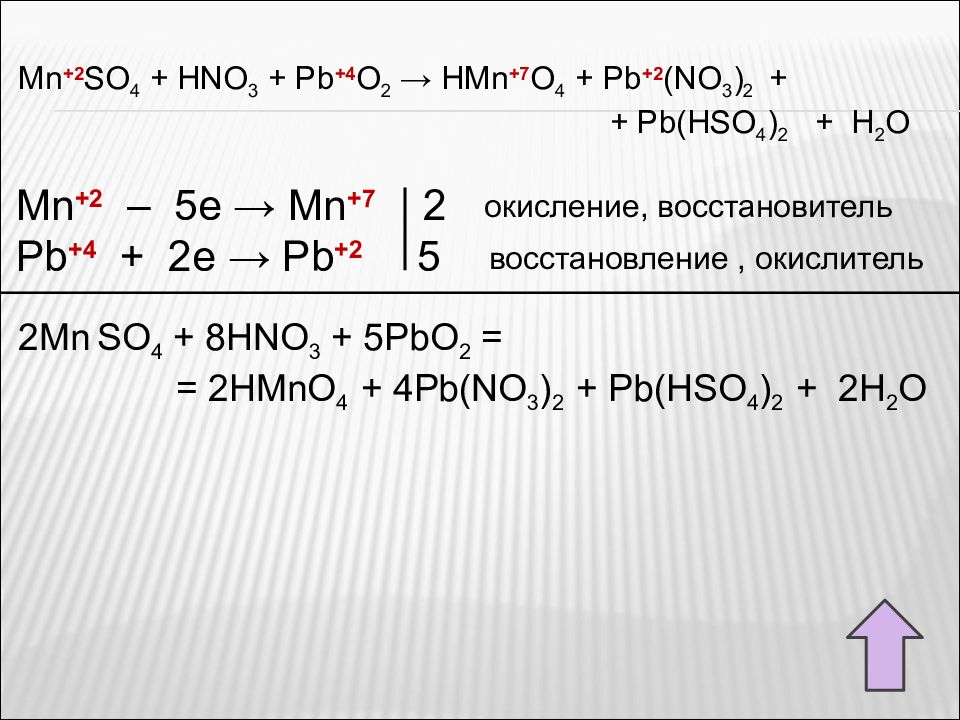
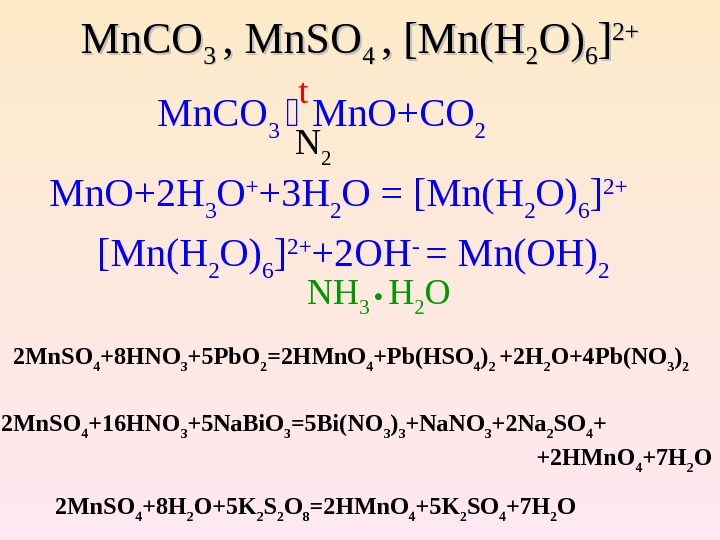
 Лучший ответ. Ирина Рудерфер Высший разум (120391) 13 лет назад. 5PbO2 + 2Mn (NO3)2+6HNO3 => 2H2O + 5Pb (NO3)2 + 2HMnO4. Окисление: Mn (2+) + 4H2O - 5e (-) => MnO4 (-) + 8H (+) - коэффициент 2- Mn (2+) - …
Лучший ответ. Ирина Рудерфер Высший разум (120391) 13 лет назад. 5PbO2 + 2Mn (NO3)2+6HNO3 => 2H2O + 5Pb (NO3)2 + 2HMnO4. Окисление: Mn (2+) + 4H2O - 5e (-) => MnO4 (-) + 8H (+) - коэффициент 2- Mn (2+) - …
 1 Mn (NO 3) 2 + 1 PbO 2 + 1 H 2 SO 4 = 1 PbSO 4 + 1 HNO 3 + 1 HMnO 4 + 1 H 2 O. For each element, we check if the number of atoms is balanced on both sides of the equation. Mn is …
1 Mn (NO 3) 2 + 1 PbO 2 + 1 H 2 SO 4 = 1 PbSO 4 + 1 HNO 3 + 1 HMnO 4 + 1 H 2 O. For each element, we check if the number of atoms is balanced on both sides of the equation. Mn is …
 HMnO 4 +Pb(NO 3) 2 + PbSO 4 + H 2 O = MnSО 4 + PbО 2 + HNO 3 Реакция протекает между такими веществами как гидроксид хрома, бром и гидроксид калия.
HMnO 4 +Pb(NO 3) 2 + PbSO 4 + H 2 O = MnSО 4 + PbО 2 + HNO 3 Реакция протекает между такими веществами как гидроксид хрома, бром и гидроксид калия.
 Mn(NO3)2 является восстановителем, PbO2 является окислителем. Решенное и коэффициентами уравнение реакции 2 Mn (NO3)2 + 5 PbO2 + 6 HNO3 → 2 HMnO4 + 5 Pb …
Mn(NO3)2 является восстановителем, PbO2 является окислителем. Решенное и коэффициентами уравнение реакции 2 Mn (NO3)2 + 5 PbO2 + 6 HNO3 → 2 HMnO4 + 5 Pb …
 In Ca 3 P 2, calcium has an oxidation number of +2, and phosphorus has an oxidation number of -3. Identify the changes in oxidation numbers: Calcium goes from 0 to +2, losing 2 electrons …
In Ca 3 P 2, calcium has an oxidation number of +2, and phosphorus has an oxidation number of -3. Identify the changes in oxidation numbers: Calcium goes from 0 to +2, losing 2 electrons …
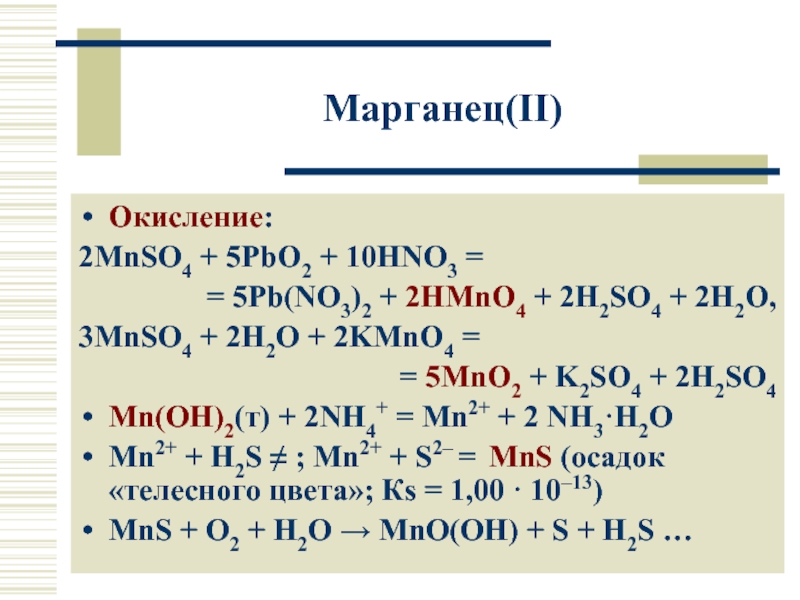
 Solved and balanced chemical equation 10 HNO3 + 2 MnSO4 + 5 PbO2 → 2 H2O + 2 H2SO4 + 5 Pb (NO3)2 + 2 HMnO4 with completed products. Application for completing products and …
Solved and balanced chemical equation 10 HNO3 + 2 MnSO4 + 5 PbO2 → 2 H2O + 2 H2SO4 + 5 Pb (NO3)2 + 2 HMnO4 with completed products. Application for completing products and …
 Balance the reaction of PbO2 + HNO3 + MnSO4 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O using this chemical equation balancer!
Balance the reaction of PbO2 + HNO3 + MnSO4 = HMnO4 + PbSO4 + Pb(NO3)2 + H2O using this chemical equation balancer!
 To be balanced, every element in PbO2 + MnO + HNO3 = HMnO4 + Pb(NO3)2 + H2O must have the same number of atoms on each side of the equation. When using the inspection method …
To be balanced, every element in PbO2 + MnO + HNO3 = HMnO4 + Pb(NO3)2 + H2O must have the same number of atoms on each side of the equation. When using the inspection method …
 Mn(NO3)2 является восстановителем, PbO2 является окислителем. Реактанты: HNO3 – Азотная кислота. Другие названия: Селитряная кислота , HNO3 , Крепкая водка..
Mn(NO3)2 является восстановителем, PbO2 является окислителем. Реактанты: HNO3 – Азотная кислота. Другие названия: Селитряная кислота , HNO3 , Крепкая водка..
 Construct the rate of reaction expression for: HNO_3 + MnO_2 + PbO_2 H_2O + Pb(NO_3)_2 + HMnO4 Plan: • Balance the chemical equation. • Determine the stoichiometric numbers. • …
Construct the rate of reaction expression for: HNO_3 + MnO_2 + PbO_2 H_2O + Pb(NO_3)_2 + HMnO4 Plan: • Balance the chemical equation. • Determine the stoichiometric numbers. • …
 Balance the chemical equation algebraically: + + + + HMnO4 Add stoichiometric coefficients, c_i, to the reactants and products: c_1 + c_2 + c_3 c_4 + c_5 + c_6 HMnO4 Set the number of …
Balance the chemical equation algebraically: + + + + HMnO4 Add stoichiometric coefficients, c_i, to the reactants and products: c_1 + c_2 + c_3 c_4 + c_5 + c_6 HMnO4 Set the number of …
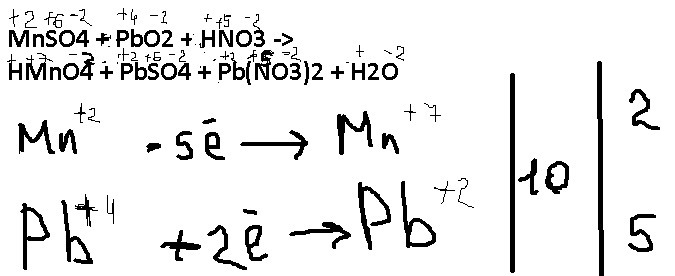 A chemical equation represents a chemical reaction. It shows the reactants (substances that start a reaction) and products (substances formed by the reaction). For example, in the reaction of …
A chemical equation represents a chemical reaction. It shows the reactants (substances that start a reaction) and products (substances formed by the reaction). For example, in the reaction of …
 Balancing step by step using the inspection method. Let's balance this equation using the inspection method. First, we set all coefficients to 1: 1 MnO + 1 PbO 2 + 1 HNO 3 = 1 HMnO 4 …
Balancing step by step using the inspection method. Let's balance this equation using the inspection method. First, we set all coefficients to 1: 1 MnO + 1 PbO 2 + 1 HNO 3 = 1 HMnO 4 …
Еще по теме:


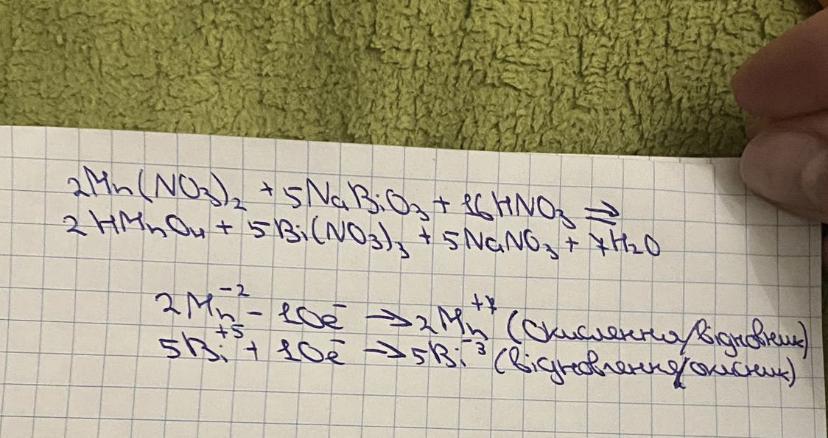


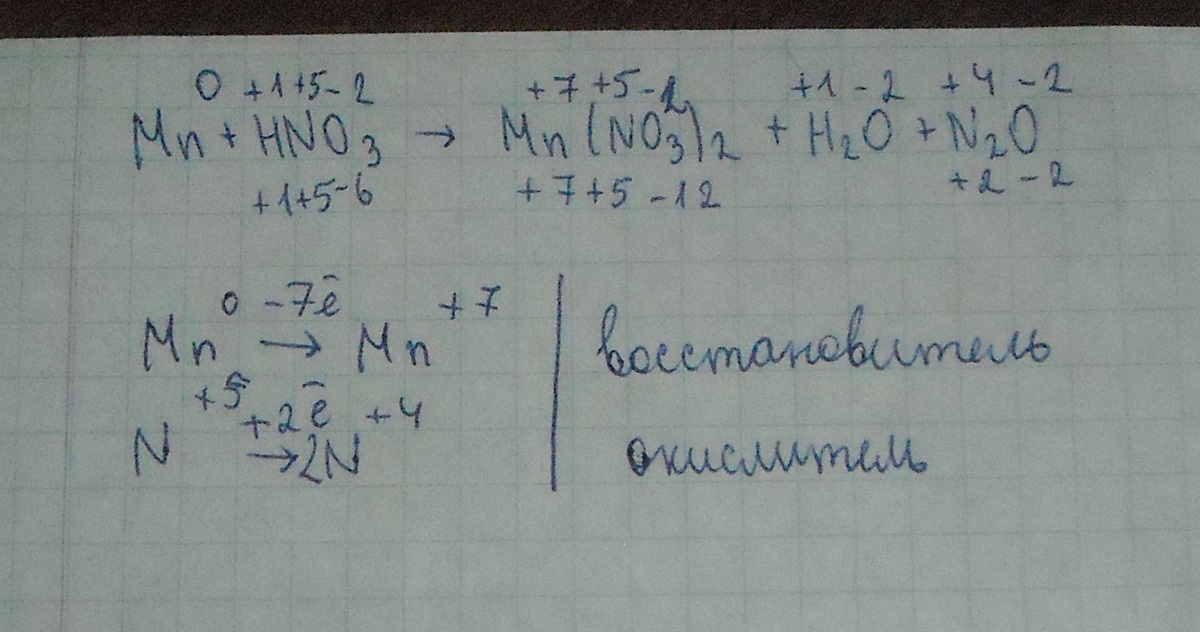








Еще по теме: