Продукты: KHSO3 – Гидросульфит калия. Другие названия: Сернистокислый калий кислый; бисульфит калия. Внешность (состояние): Бесцветные кристаллы. Решенное и коэффициентами уравнение реакции SO2 + KOH → KHSO3 с дополненными …
Продукты: KHSO3 – Гидросульфит калия. Другие названия: Сернистокислый калий кислый; бисульфит калия. Внешность (состояние): Бесцветные кристаллы. Решенное и коэффициентами уравнение реакции SO2 + KOH → KHSO3 с дополненными …
 Решенное и коэффициентами уравнение реакции SO2 + 2 KOH → K2SO3 + H2O с дополненными продуктами.
Решенное и коэффициентами уравнение реакции SO2 + 2 KOH → K2SO3 + H2O с дополненными продуктами.
 khso 3 + koh = k 2 so 3 + h 2 o. Здесь все просто, кислую соль превращаем в среднюю под действием щелочи. so 2 + koh(изб.) = k 2 so 3 + h 2 o . здесь избыток щелочи, а не …
khso 3 + koh = k 2 so 3 + h 2 o. Здесь все просто, кислую соль превращаем в среднюю под действием щелочи. so 2 + koh(изб.) = k 2 so 3 + h 2 o . здесь избыток щелочи, а не …
 Реальное задание 9 из ЕГЭ по химии 2020 (основная волна). Образование средних и кислых солей. Избыток и.
Реальное задание 9 из ЕГЭ по химии 2020 (основная волна). Образование средних и кислых солей. Избыток и.
 Будь первым, кто ответит на вопрос. Что образуется при взаимодействии KOH в избытке и недостатке с SO2 (оксидом серы 4) - ответ на этот и другие вопросы получите онлайн на …
Будь первым, кто ответит на вопрос. Что образуется при взаимодействии KOH в избытке и недостатке с SO2 (оксидом серы 4) - ответ на этот и другие вопросы получите онлайн на …
 Запрос so2 + koh распознан сайтом как сернистый газ + гидроксид калия
Запрос so2 + koh распознан сайтом как сернистый газ + гидроксид калия
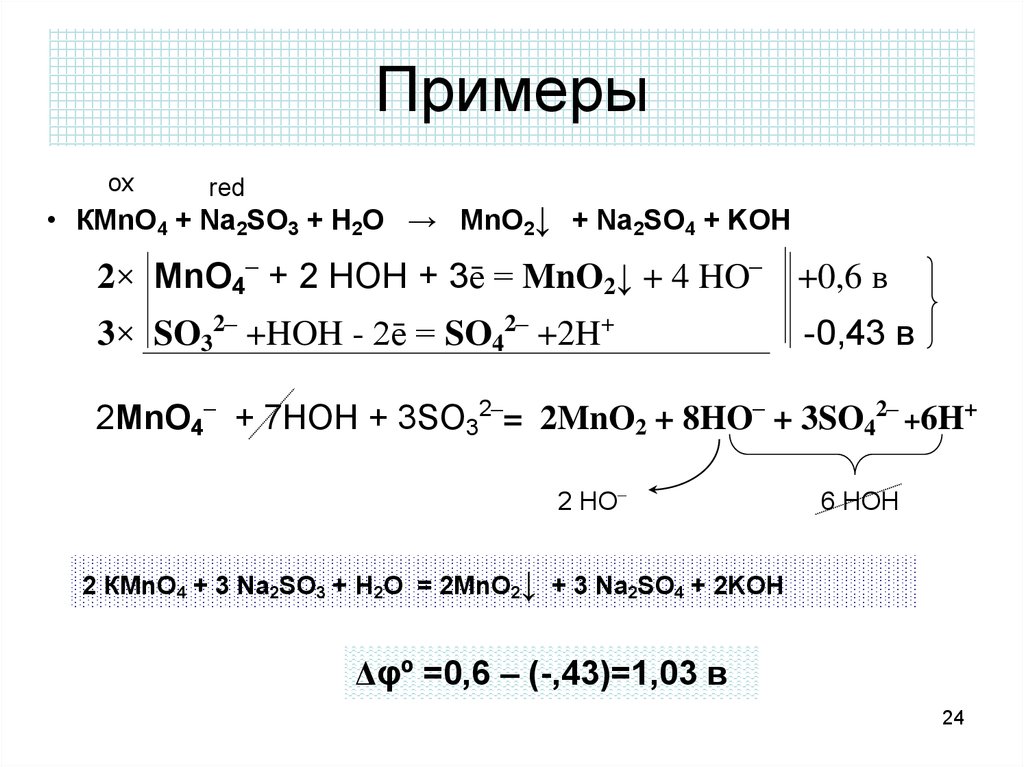 В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H 2 S, SO 2. H 2 S + O 2 = S + H 2 O (недостаток кислорода) SO 2 + C = (t) S + CO 2. Серу можно получить …
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H 2 S, SO 2. H 2 S + O 2 = S + H 2 O (недостаток кислорода) SO 2 + C = (t) S + CO 2. Серу можно получить …
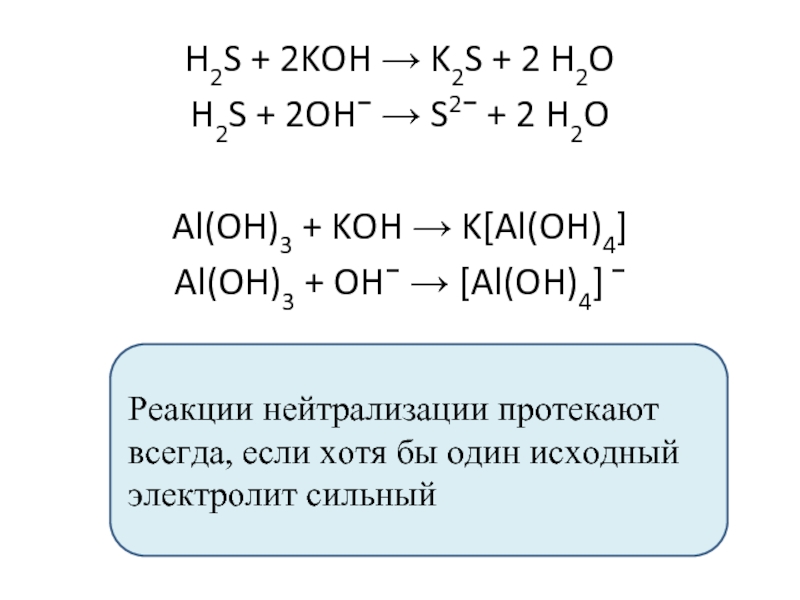
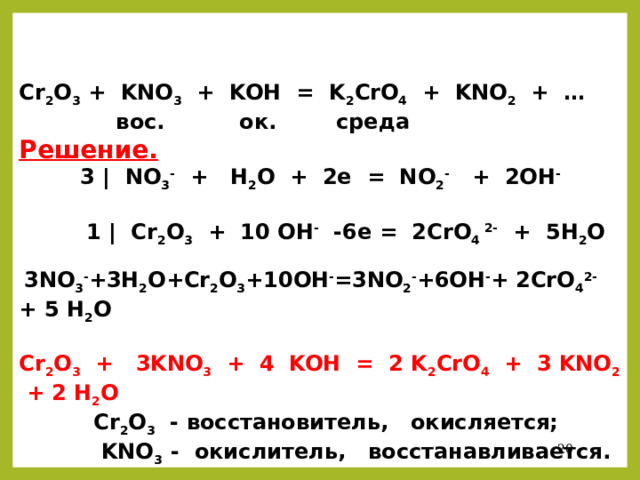 Если в результате обменной реакции получается соль, которая необратимо гидролизуется, то идет двойной гидролиз: Al (NO₃)₃ + KHCO₃ → Al (OH)₃ + CO₂ + KNO₃. Реакции с …
Если в результате обменной реакции получается соль, которая необратимо гидролизуется, то идет двойной гидролиз: Al (NO₃)₃ + KHCO₃ → Al (OH)₃ + CO₂ + KNO₃. Реакции с …
 SO2+KOH (изб) =. ирина конопляникова Ученик (246), на голосовании 9 лет назад. Голосование за лучший ответ. ку )) Гуру (3764) 9 лет назад. Забей в поисковик нигма. ру, …
SO2+KOH (изб) =. ирина конопляникова Ученик (246), на голосовании 9 лет назад. Голосование за лучший ответ. ку )) Гуру (3764) 9 лет назад. Забей в поисковик нигма. ру, …
 Продукты: KHSO3 – Гидросульфит калия. Другие названия: Сернистокислый калий кислый; бисульфит калия. Внешность (состояние): Бесцветные кристаллы. Решенное и …
Продукты: KHSO3 – Гидросульфит калия. Другие названия: Сернистокислый калий кислый; бисульфит калия. Внешность (состояние): Бесцветные кристаллы. Решенное и …
 Расширенный поиск. Или Попробуйте случайную реакцию. Приложение для вычисления и дополнения продуктов реакции. Ионные и окислительно-восстановительные реакции!
Расширенный поиск. Или Попробуйте случайную реакцию. Приложение для вычисления и дополнения продуктов реакции. Ионные и окислительно-восстановительные реакции!
 Реальное задание 9 из ЕГЭ по химии 2020 (основная волна). Образование средних и кислых солей. Избыток и недостаток щелочи. Условие: Задание на соответствие. …
Реальное задание 9 из ЕГЭ по химии 2020 (основная волна). Образование средних и кислых солей. Избыток и недостаток щелочи. Условие: Задание на соответствие. …
 2KOH + CO2 (нед) = K2CO3 + H2O. KOH + CO2 (изб) = KHCO3. Похожие вопросы. Пользователь Екатерина Васильева задал вопрос в категории ВУЗы, Колледжи и …
2KOH + CO2 (нед) = K2CO3 + H2O. KOH + CO2 (изб) = KHCO3. Похожие вопросы. Пользователь Екатерина Васильева задал вопрос в категории ВУЗы, Колледжи и …
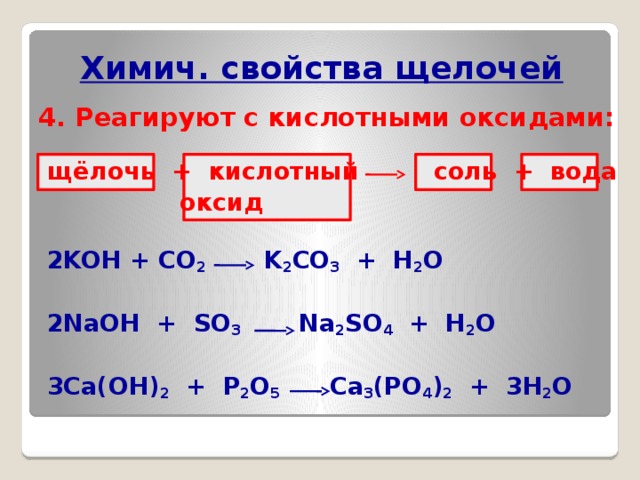
 1) Реагируют с co2 и so2 с образованием амфотерных гидроксидов (могут образовываться как средние, так и ксилые соли): na[al(oh)4] + co2 → nahco3 + al(oh)3 или 2na[al(oh)4] + …
1) Реагируют с co2 и so2 с образованием амфотерных гидроксидов (могут образовываться как средние, так и ксилые соли): na[al(oh)4] + co2 → nahco3 + al(oh)3 или 2na[al(oh)4] + …
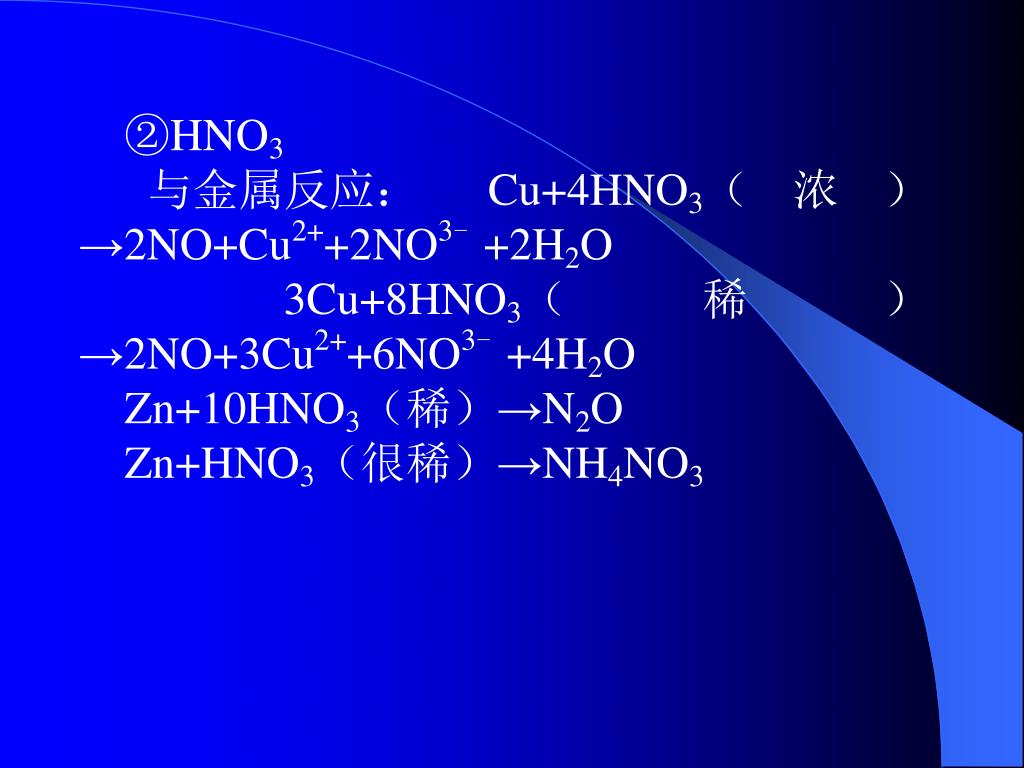
 Рассчитайте массу восстановленной формы окислителя в приведенной ниже реакции, если образовался 1 моль окисленной формы восстановителя а) zn + koh(изб.) + h2o = б) …
Рассчитайте массу восстановленной формы окислителя в приведенной ниже реакции, если образовался 1 моль окисленной формы восстановителя а) zn + koh(изб.) + h2o = б) …
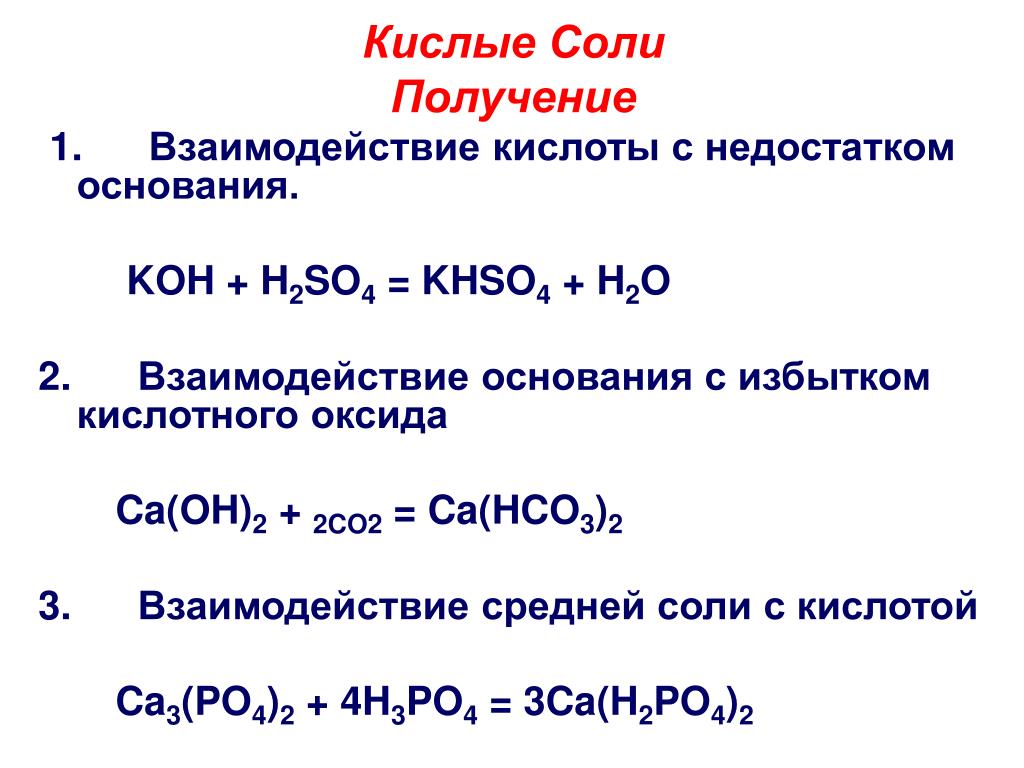
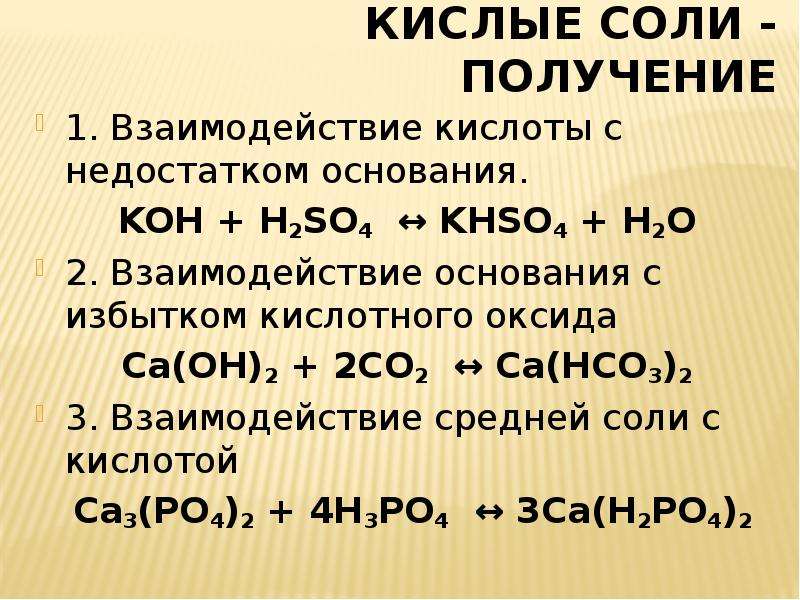
 H2SO4 + KOH → KHSO4 + H2O (соотношение реагентов 1:1) HCl + Cu(OH)2 → CuOHCl + H2O или 2HCl + Cu(OH)2 → CuCl2 + 2H2O. H2SiO3 + Cu(OH)2 → реакция не идет, так как …
H2SO4 + KOH → KHSO4 + H2O (соотношение реагентов 1:1) HCl + Cu(OH)2 → CuOHCl + H2O или 2HCl + Cu(OH)2 → CuCl2 + 2H2O. H2SiO3 + Cu(OH)2 → реакция не идет, так как …
Еще по теме:





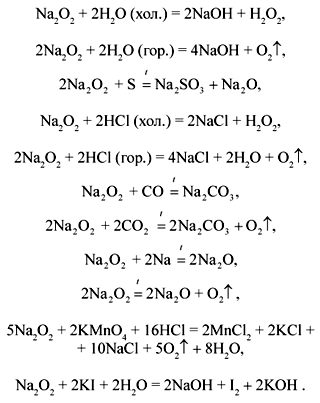






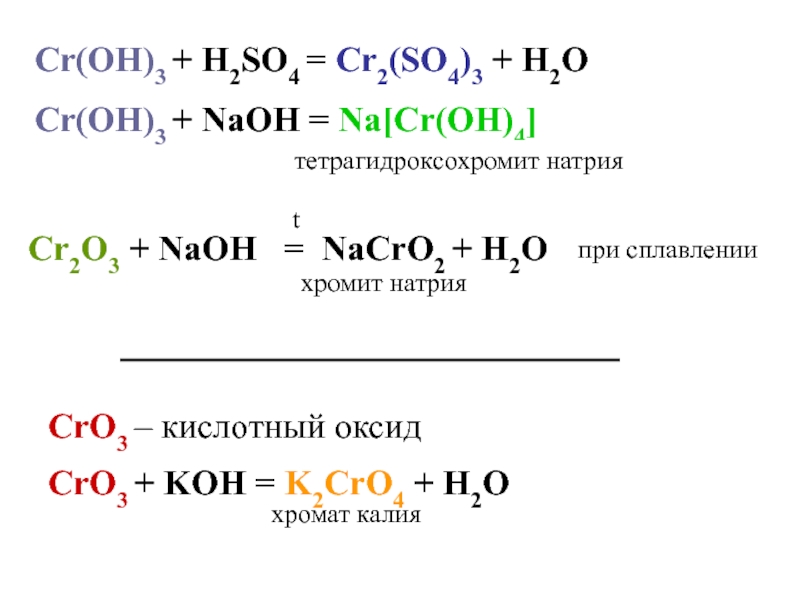

Еще по теме: