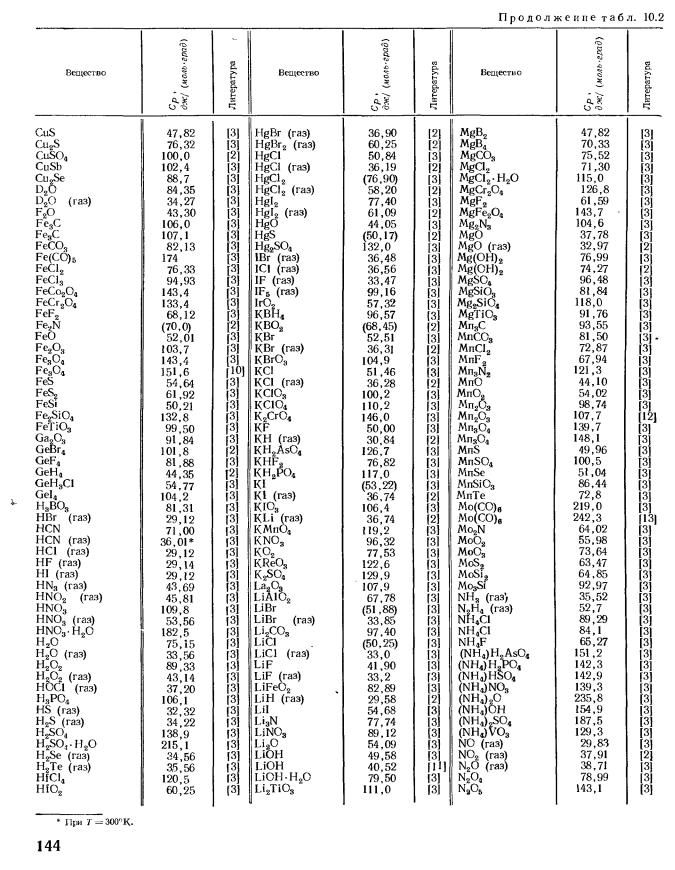
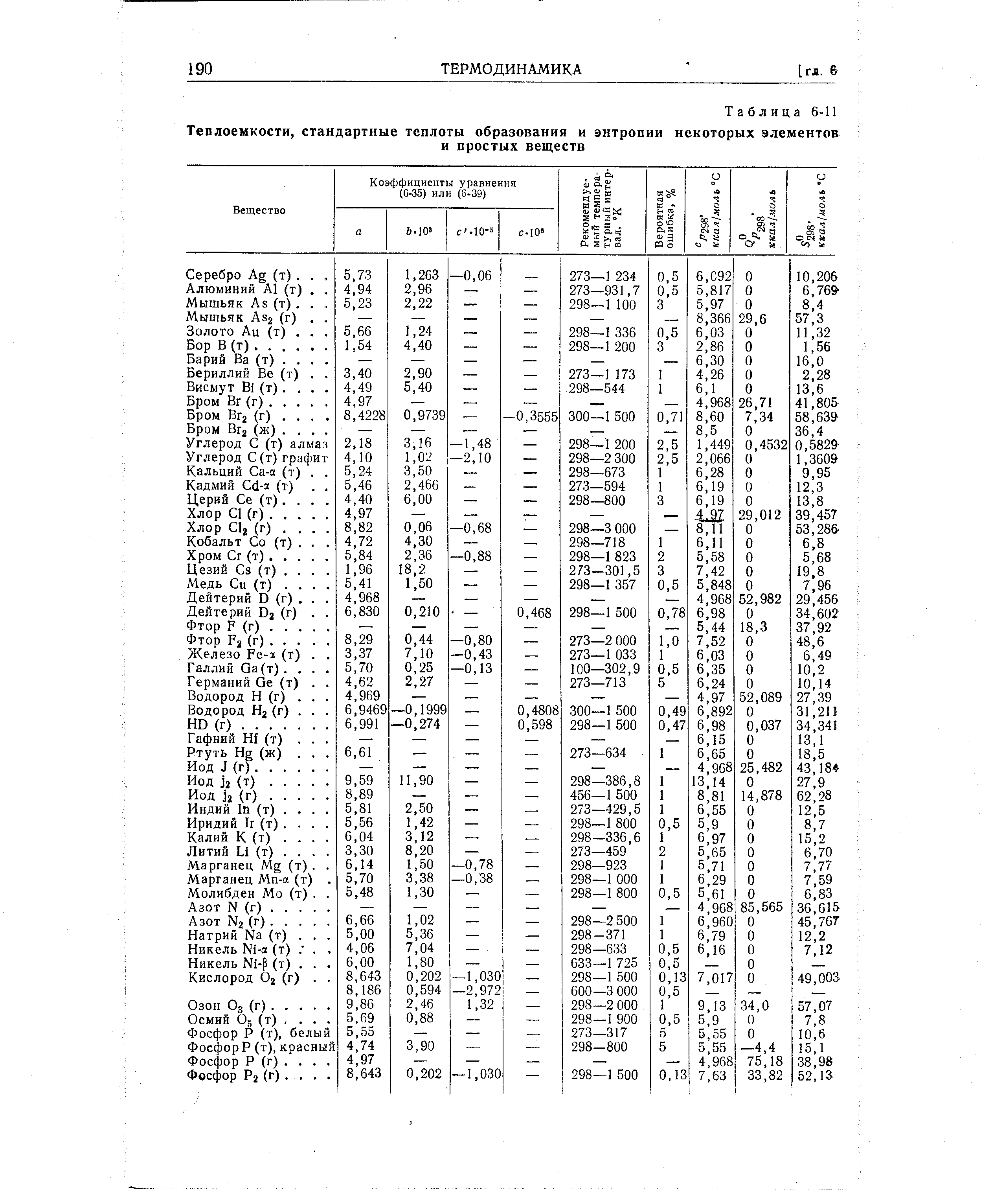
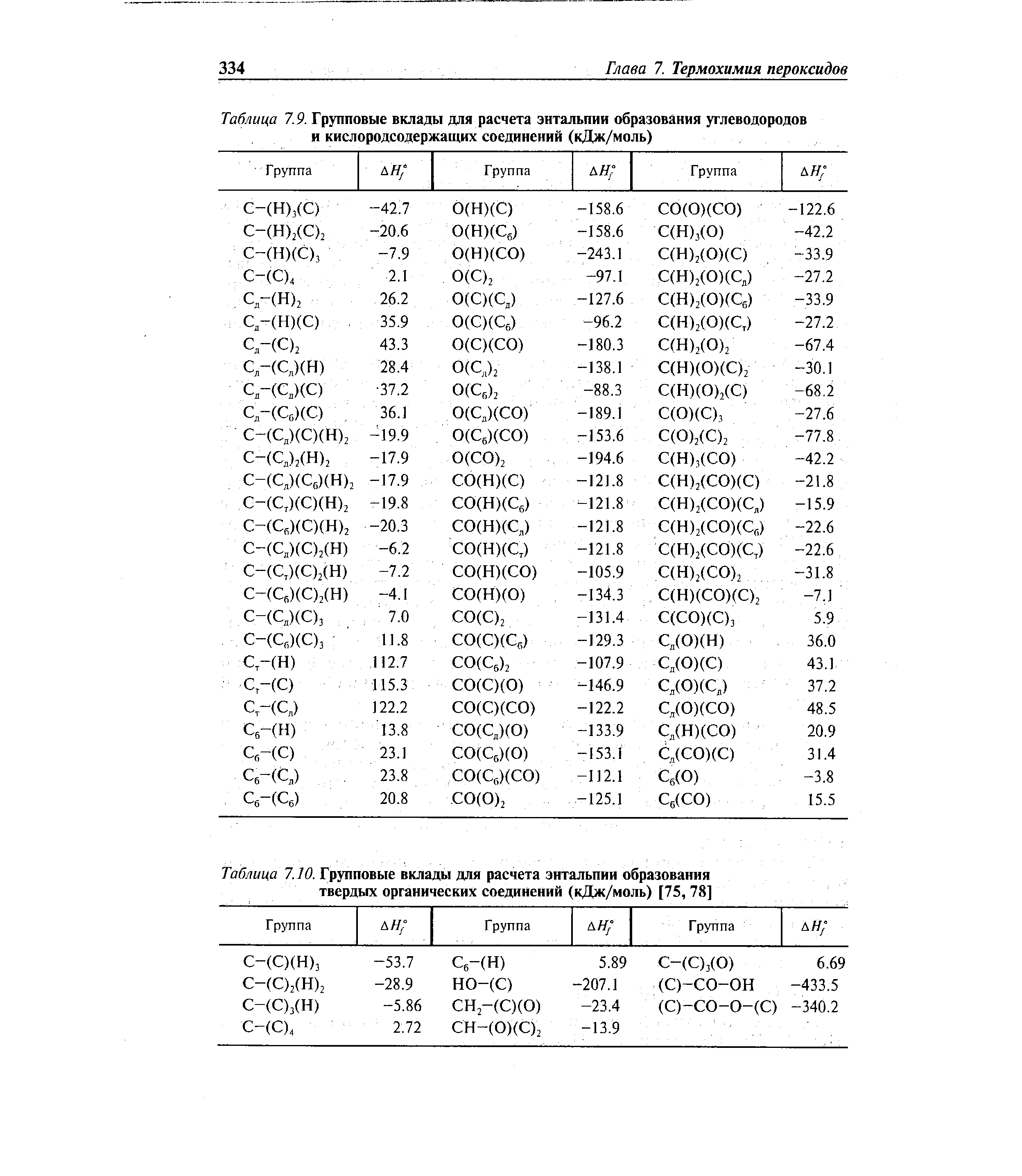
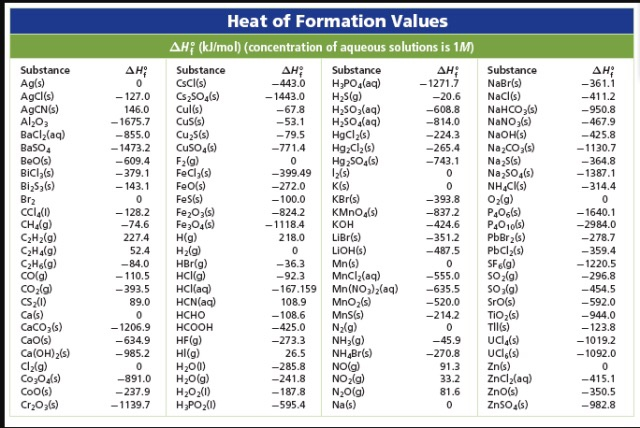
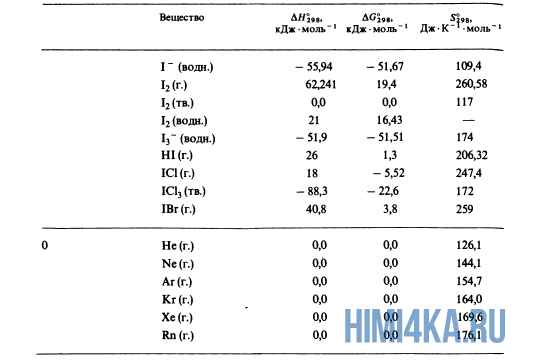
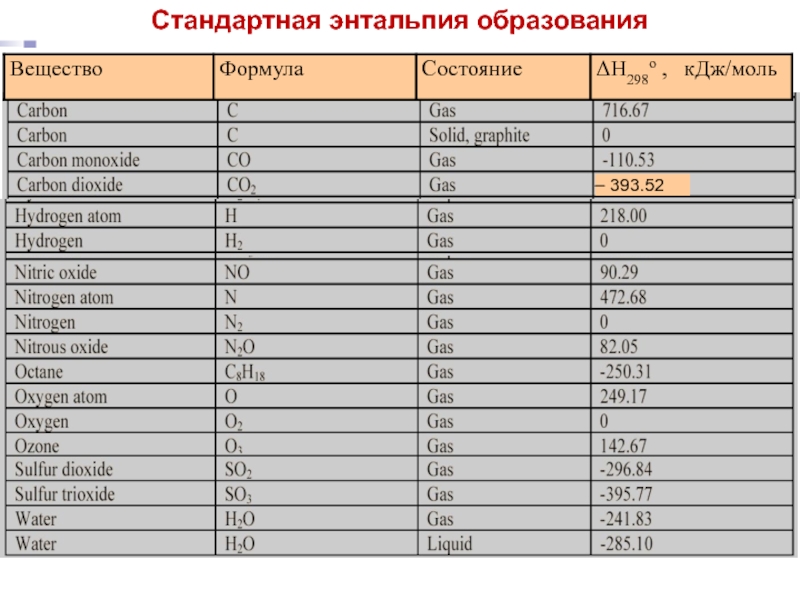
Большая справочная таблица с удобным поиском. Информация ΔH° 298 — стандартная энтальпия образования вещества (кДж/моль).
Большая справочная таблица с удобным поиском. Информация ΔH° 298 — стандартная энтальпия образования вещества (кДж/моль).
 Стандартная энтальпия образования химического соединения – мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения.
Стандартная энтальпия образования химического соединения – мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения.
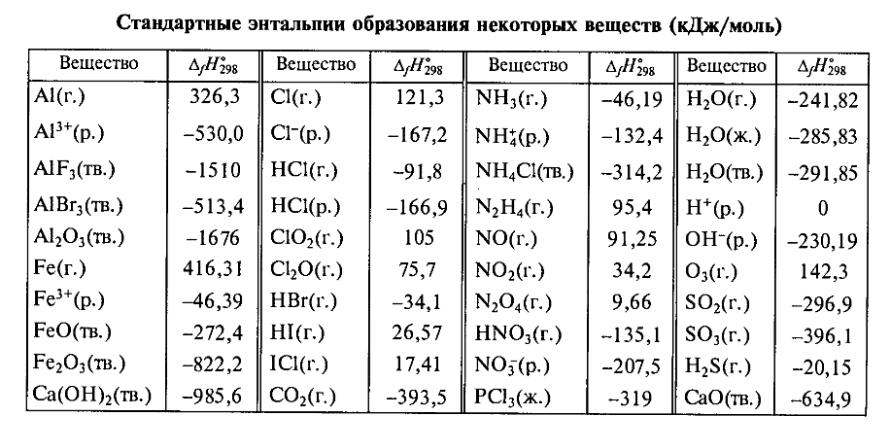
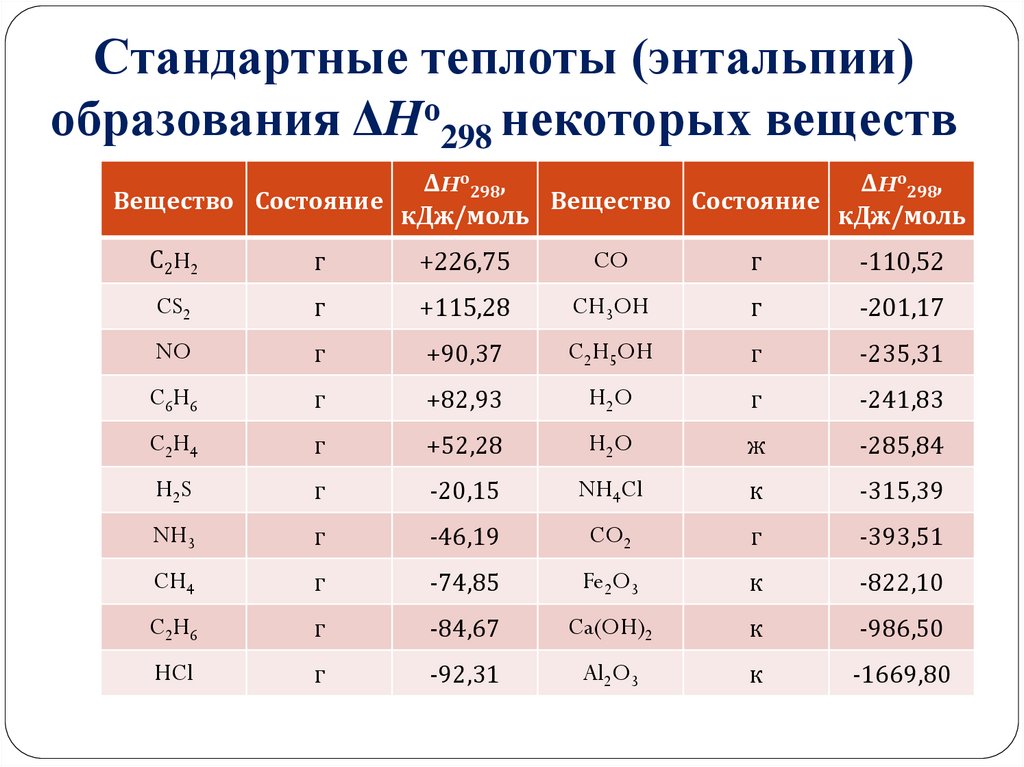
 На странице собраны стандартные энтальпии образования распространённых веществ
На странице собраны стандартные энтальпии образования распространённых веществ
 Стандартная энтальпия образования (Δ f H° (298)) – энергетический эффект реакции синтеза 1 моля данного вещества из простых веществ, взятых в их наиболее устойчивых физических состояниях при внешнем давлении 1 атм и данной температуре.
Стандартная энтальпия образования (Δ f H° (298)) – энергетический эффект реакции синтеза 1 моля данного вещества из простых веществ, взятых в их наиболее устойчивых физических состояниях при внешнем давлении 1 атм и данной температуре.
 Раздел недели: Таблицы численных значений. (Таблица квадратов, кубов, синусов..) + Таблицы Брадиса
Раздел недели: Таблицы численных значений. (Таблица квадратов, кубов, синусов..) + Таблицы Брадиса
 Большая справочная таблица с удобным поиском. Информация ΔH° сгор., 298 — стандартная энтальпия сгорания вещества (кДж/моль).
Большая справочная таблица с удобным поиском. Информация ΔH° сгор., 298 — стандартная энтальпия сгорания вещества (кДж/моль).
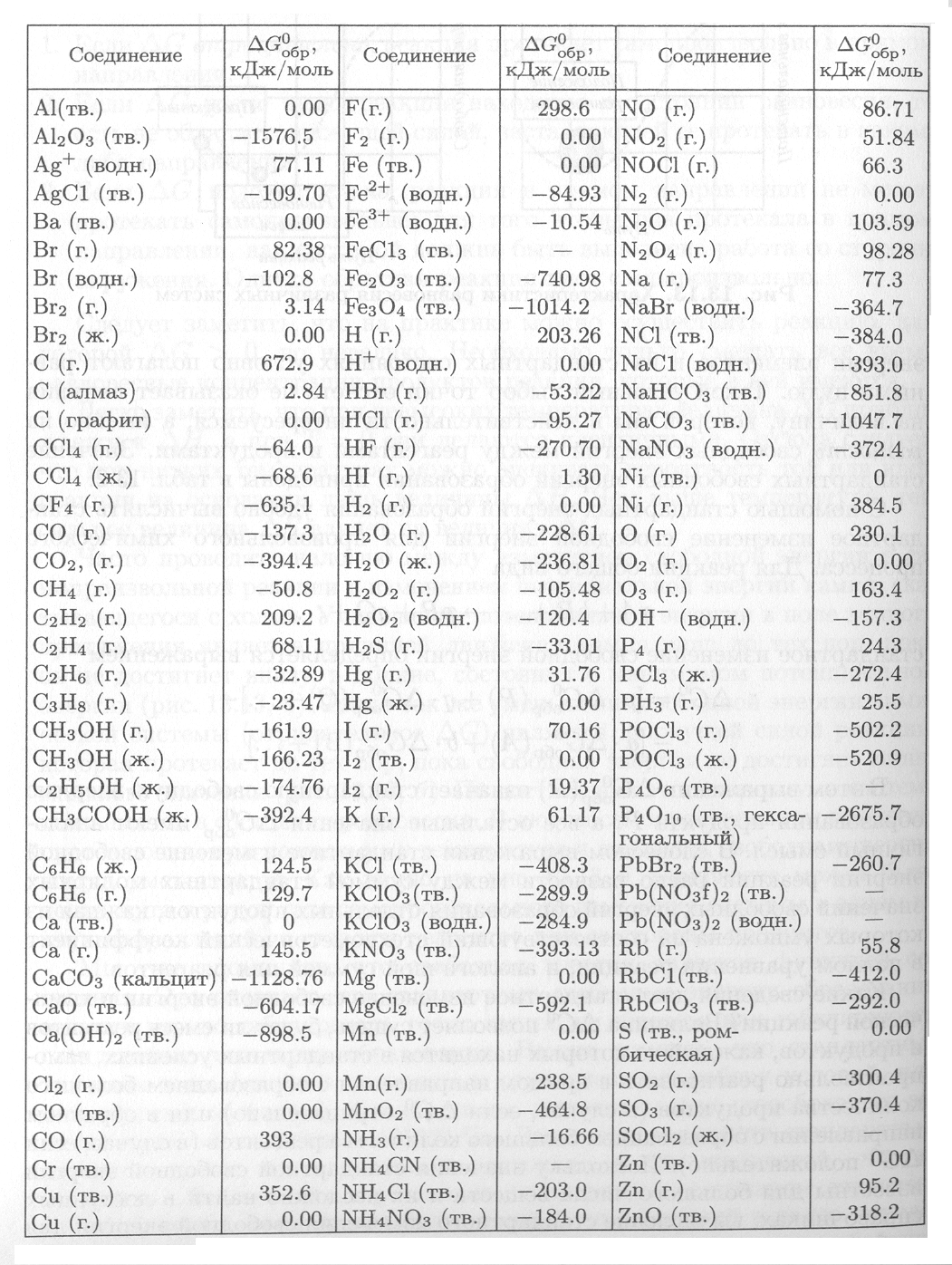
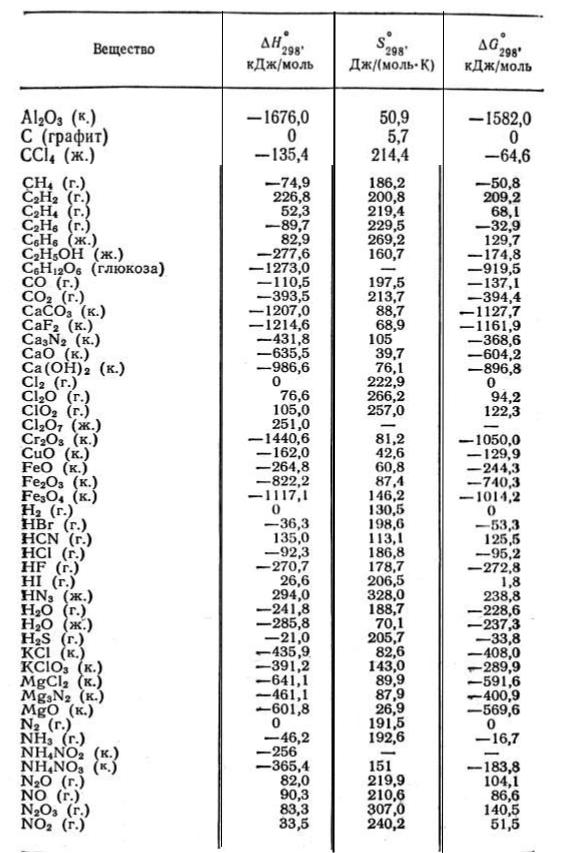
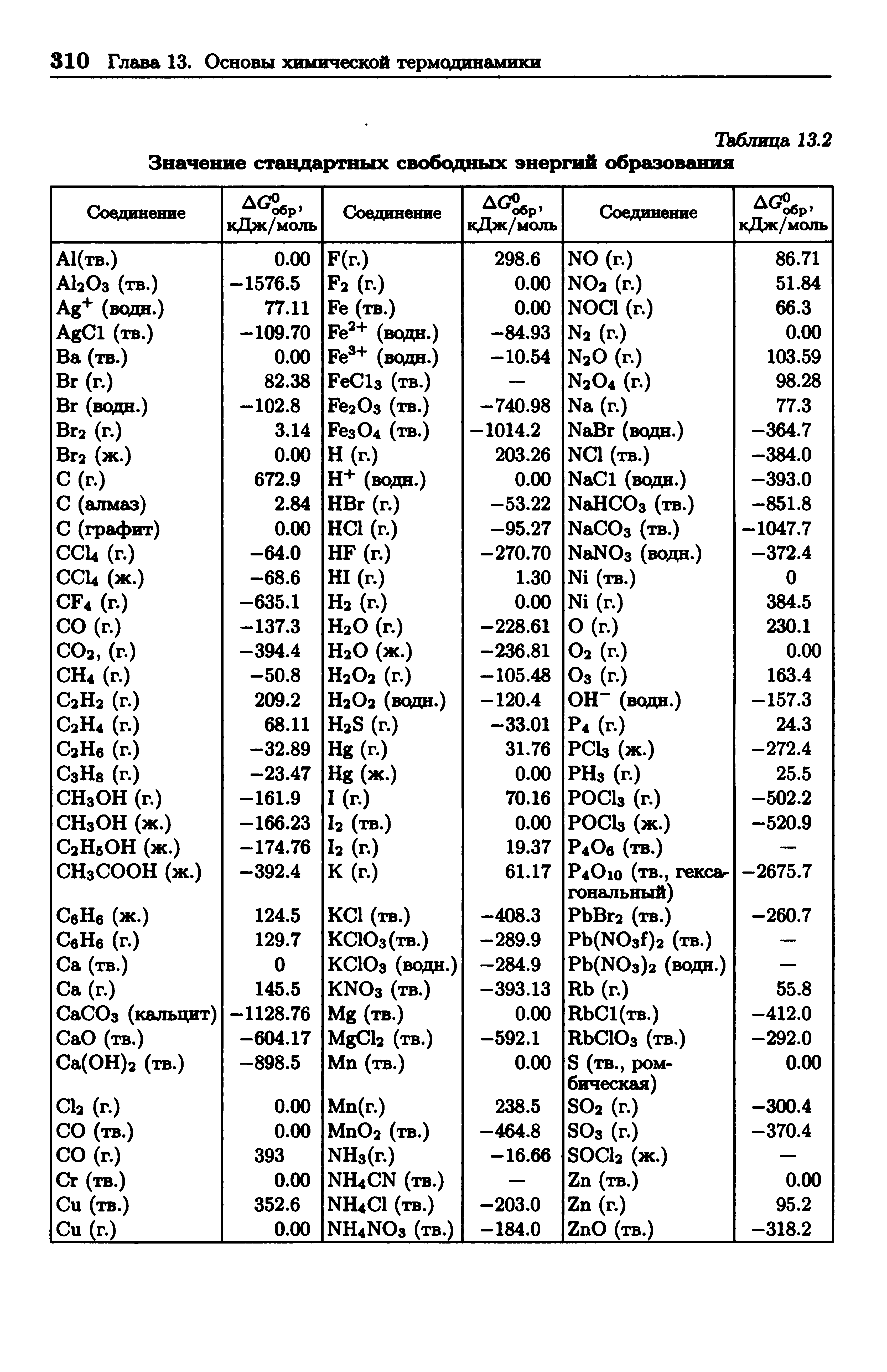
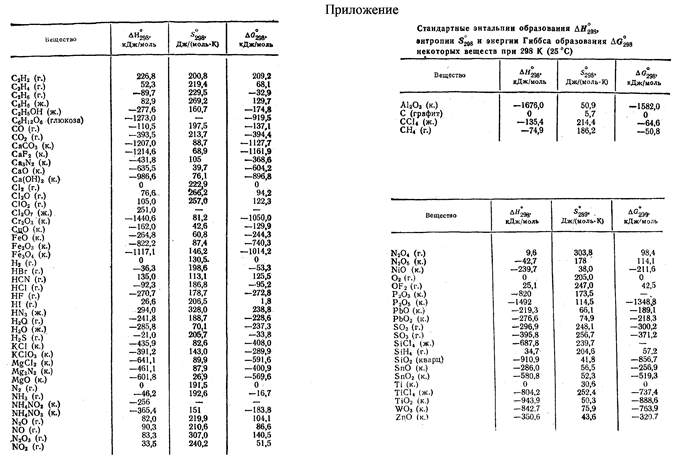
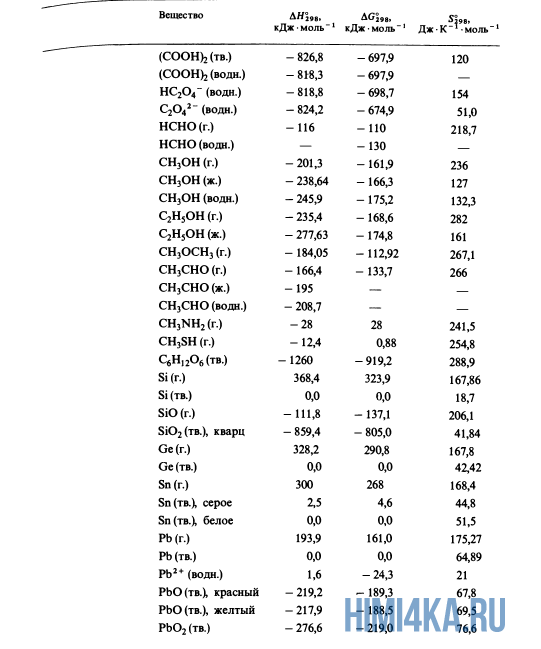
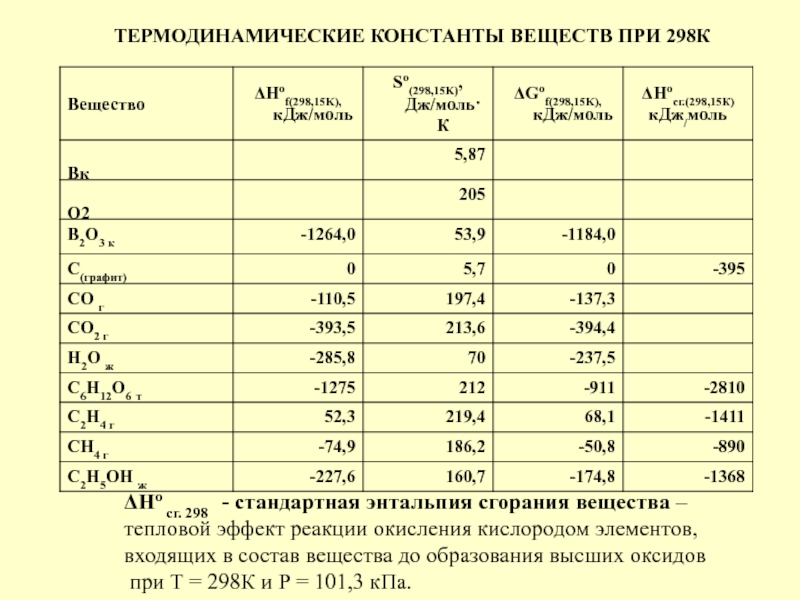
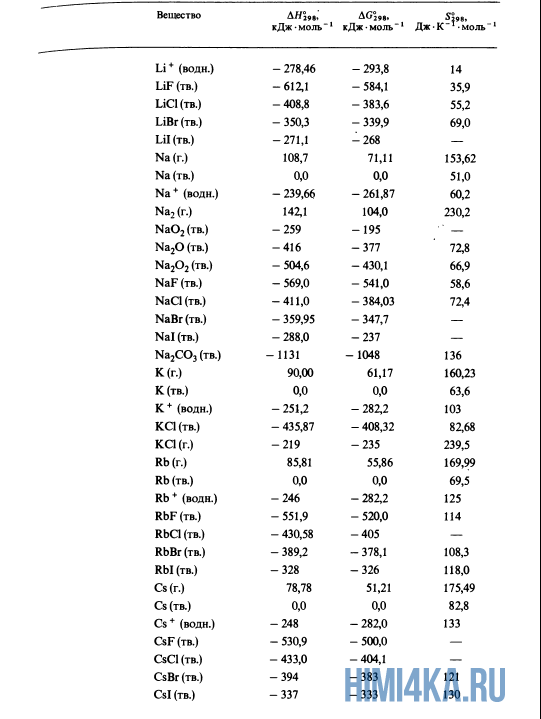
 Стандартные энтальпии образования Δ H o обр. , стандартные энергии Гиббса образования Δ G o обр. неорганических веществ и их стандартные энтропии S o при 298,15 К Tehtab.ru - Инженерный справочник
Стандартные энтальпии образования Δ H o обр. , стандартные энергии Гиббса образования Δ G o обр. неорганических веществ и их стандартные энтропии S o при 298,15 К Tehtab.ru - Инженерный справочник
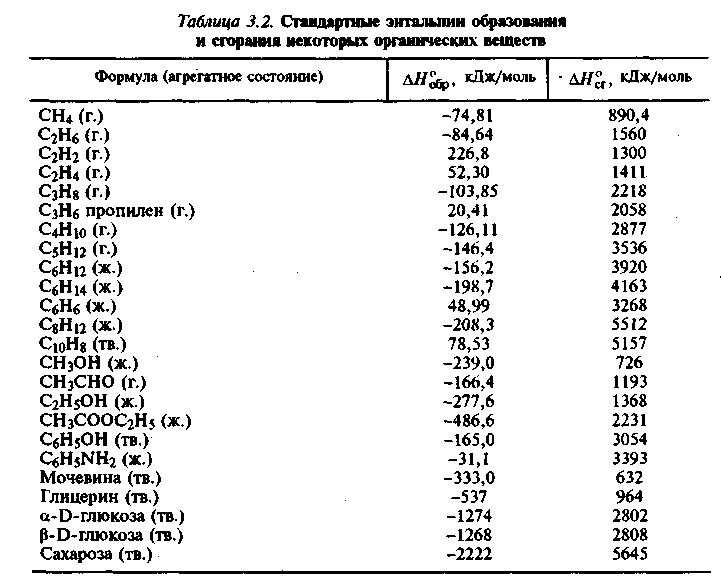
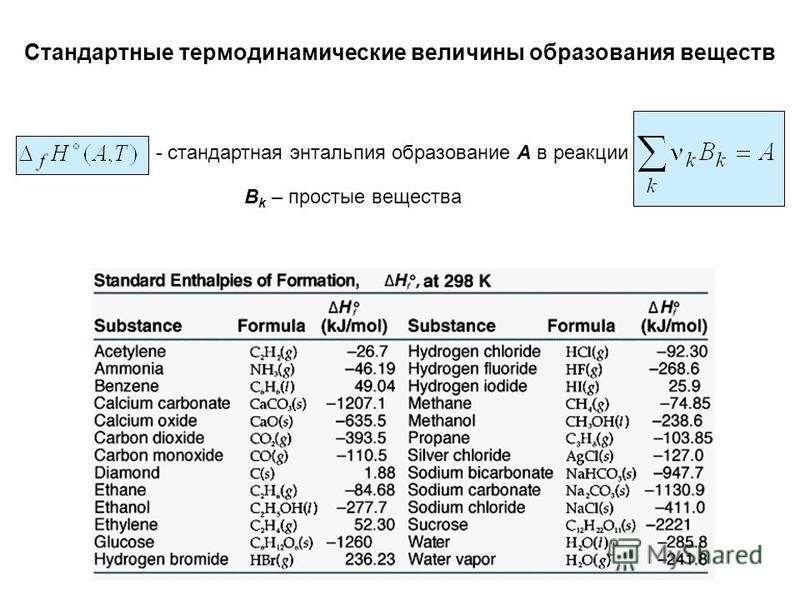
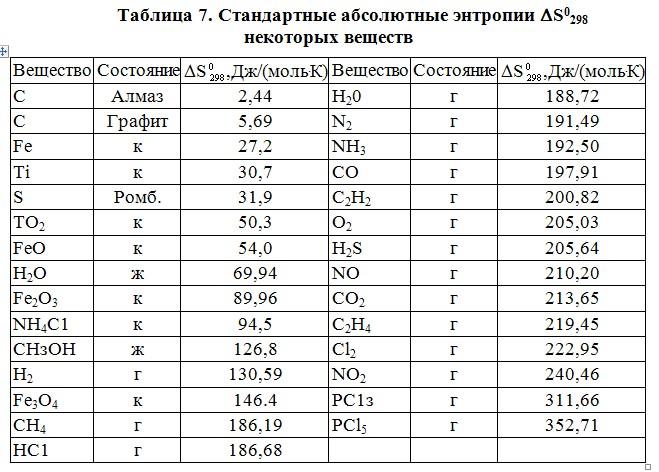
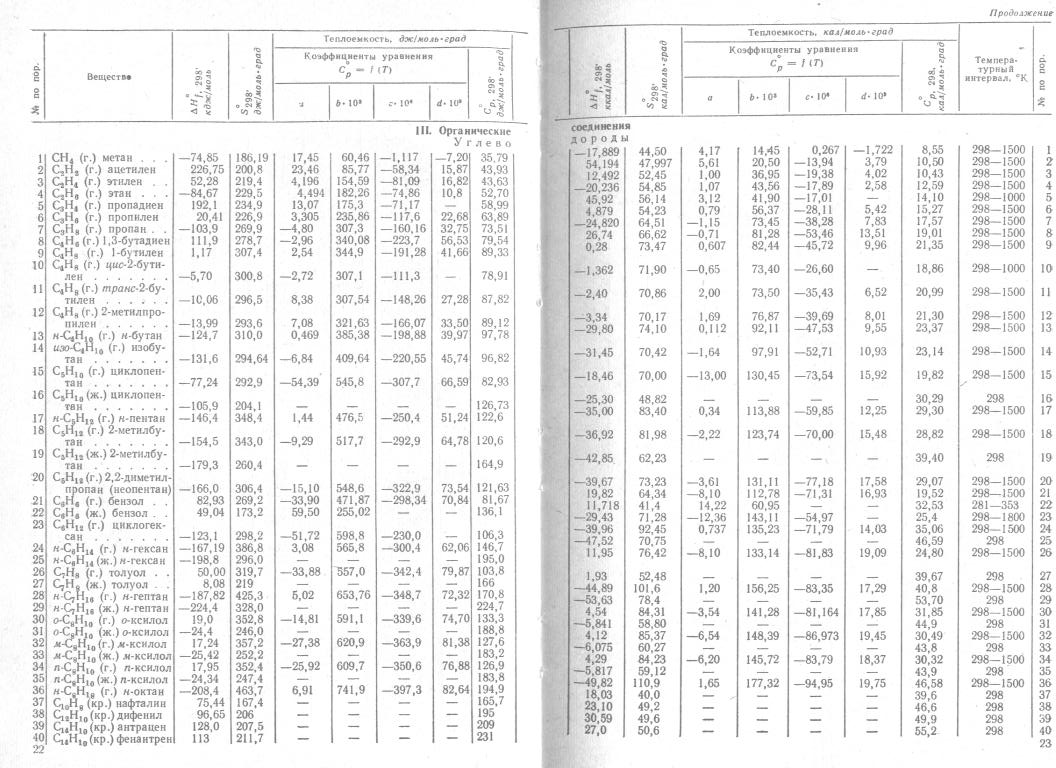
 Энтальпия и энтропия в таблицах. Для удобства расчетов тепловых эффектов реакций используются справочные таблицы стандартных энтропий и энтальпий. Пример такой таблицы:
Энтальпия и энтропия в таблицах. Для удобства расчетов тепловых эффектов реакций используются справочные таблицы стандартных энтропий и энтальпий. Пример такой таблицы:
 Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из.
Стандартная энтальпия образования ΔН о f,298 (или ΔН о обр,298) – это изменение энтальпии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из.
 Стандартная энтальпия образования обозначается Δ H fO. Здесь индекс f означает formation (образование), а перечеркнутый кружок, напоминающий диск Плимсоля [1] — то, что величина относится к стандартному состоянию вещества.
Стандартная энтальпия образования обозначается Δ H fO. Здесь индекс f означает formation (образование), а перечеркнутый кружок, напоминающий диск Плимсоля [1] — то, что величина относится к стандартному состоянию вещества.
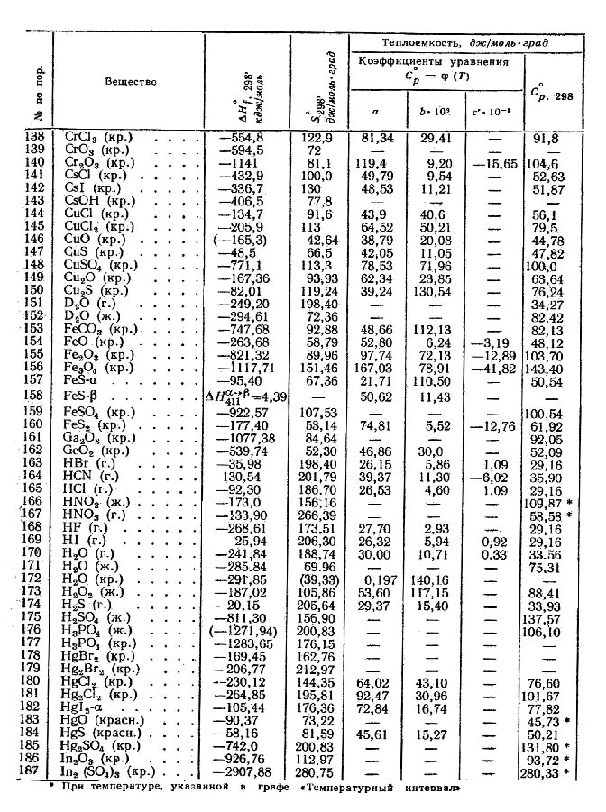 Знание стандартной энтальпии образования вещества позволяет рассчитать тепловые эффекты химических реакций. Давайте разберемся, как определить энтальпию образования различных веществ. Для простых веществ в их стандартном состоянии стандартная энтальпия образования равна нулю.
Знание стандартной энтальпии образования вещества позволяет рассчитать тепловые эффекты химических реакций. Давайте разберемся, как определить энтальпию образования различных веществ. Для простых веществ в их стандартном состоянии стандартная энтальпия образования равна нулю.
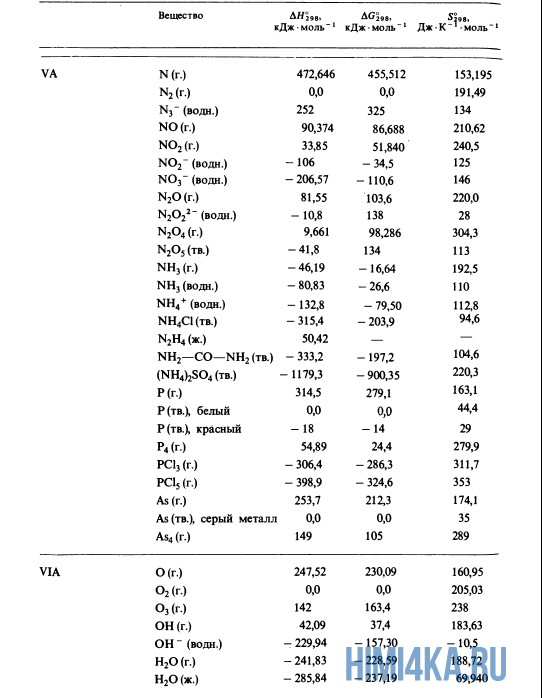 Стандартная энтальпия не обязательно должна быть энтальпией образования вещества из элементов. Можно получить значение стандартной энтальпии ΔН о 298 для любой химической реакции.
Стандартная энтальпия не обязательно должна быть энтальпией образования вещества из элементов. Можно получить значение стандартной энтальпии ΔН о 298 для любой химической реакции.
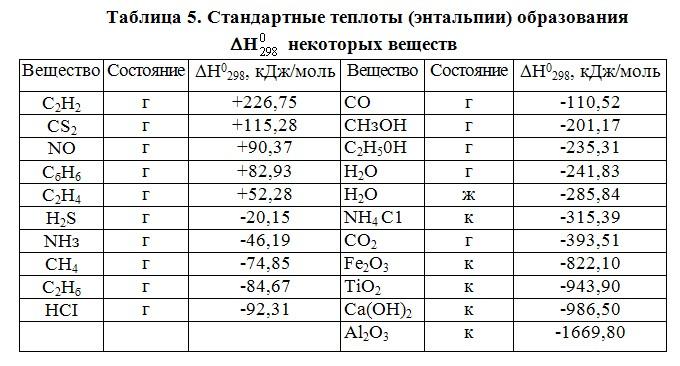 Рассчитать стандартную энтальпию образования можно с помощью следующей формулы: ΔH°обр = ΣnΔH°продуктов – ΣmΔH°реагентов. Где: ΔH°реагентов – стандартная энтальпия образования реагентов. Энтальпии образования реагентов и продуктов можно найти в специальных справочниках или использовать табличные значения.
Рассчитать стандартную энтальпию образования можно с помощью следующей формулы: ΔH°обр = ΣnΔH°продуктов – ΣmΔH°реагентов. Где: ΔH°реагентов – стандартная энтальпия образования реагентов. Энтальпии образования реагентов и продуктов можно найти в специальных справочниках или использовать табличные значения.
 Рассчитайте стандартную энтальпию образования гидроксида натрия в водном растворе при T = 298,15K. Δ sol H° (298, NaOH·∞H 2 O, р-р) = –10,245 ккал/моль. Тогда: Δ f H° (298, NaOH, р-р) = Δ f H° (298, KOH, к) + Δ sol H° (298, KOH·∞H 2 O, р-р) = –101,72 + (–10,245) = –111,97 ккал/моль. Ответ: ΔfH° (298, NaOH, р-р) = –111,97 ккал/моль.
Рассчитайте стандартную энтальпию образования гидроксида натрия в водном растворе при T = 298,15K. Δ sol H° (298, NaOH·∞H 2 O, р-р) = –10,245 ккал/моль. Тогда: Δ f H° (298, NaOH, р-р) = Δ f H° (298, KOH, к) + Δ sol H° (298, KOH·∞H 2 O, р-р) = –101,72 + (–10,245) = –111,97 ккал/моль. Ответ: ΔfH° (298, NaOH, р-р) = –111,97 ккал/моль.
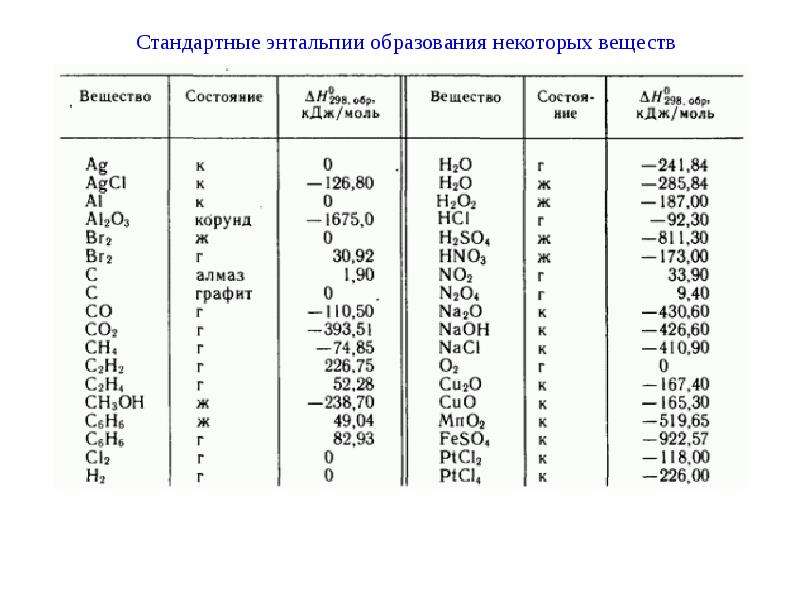 Для расчета стандартной энтальпии реакции необходимо выполнить следующие шаги: Определить химическое уравнение реакции, включая фазы веществ (газ, жидкость, твердое вещество). Найти табличные значения стандартной энтальпии образования веществ из химического уравнения.
Для расчета стандартной энтальпии реакции необходимо выполнить следующие шаги: Определить химическое уравнение реакции, включая фазы веществ (газ, жидкость, твердое вещество). Найти табличные значения стандартной энтальпии образования веществ из химического уравнения.
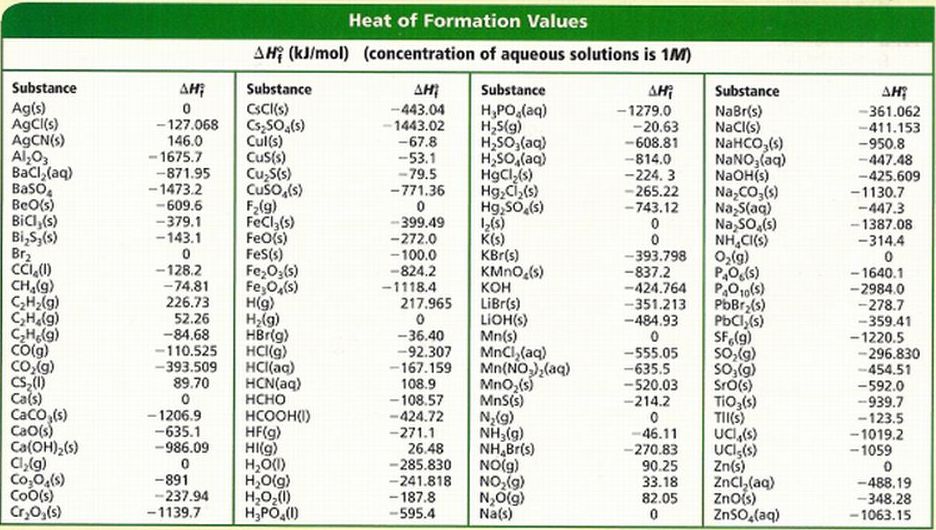 Стандартная энтальпия образования соединения — мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения.
Стандартная энтальпия образования соединения — мера его термодинамической устойчивости, прочности, количественное выражение энергетических свойств соединения.
Еще по теме:

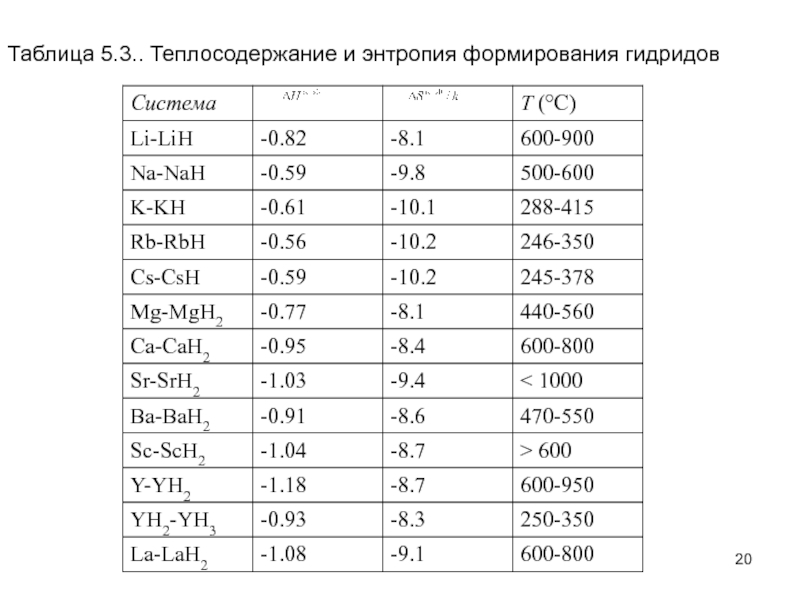






Еще по теме: